Самопроизвольно реакция может протекать только в направлении уменьшения энергии Гиббса.
Из этого следует, что в изобарно-изотермических условиях в изолированной системе самопроизвольно протекают те процессы, которые сопровождаются увеличением энтропии.
Действительно, в изолированной системе теплообмен невозможен, следовательно, DH = 0 и DG » -T×DS. Отсюда видно, что если DS>0, то DG < 0 и, следовательно, процесс может самопроизвольно протекать в прямом направлении.
Другая формулировка II закона термодинамики:
Невозможен некомпенсированный переход теплоты от менее нагретых тел к более нагретым[7].
Вычислить свободную энергию реакции (изменение свободной энергии реакции) можно не только по уравнению Гиббса (16), но и по свободным энергиям Гиббса образования веществ (табличные данные).
Стандартным изменением энергии Гиббса (энергией Гиббса) образования вещества называется изменение энергии Гиббса образования 1 моль вещества в стандартном состоянии из соответствующих простых веществ, также взятых в стандартных состояниях. При этом стандартные энергии Гиббса образования простых веществ в наиболее устойчивых их формах принимаются равными нулю: ΔGoобр.(Н2) = 0; ΔGoобр.(О2) = 0.
Рассчитывая энтропию и энергию Гиббса химических реакций, руководствуются законом Гесса.
Так, для реакции:
aA + bB = cC + dD
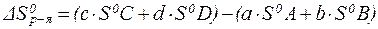 | (17) |
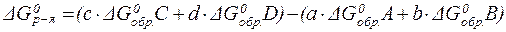 | (18) |
Процессы, в которых энергия Гиббса убывает ΔGр-я < 0, называются экзэргоническими,а при которых энергия Гиббса возрастает ∆Gр-я > 0, называются эндэргоническими,самопроизвольно они не протекают.
Эндэргонические процессы реализуются в природе в том случае, если они сопряжены с какими-то экзэргоническими реакциями:
Например, в организме реализуется реакция:
глюкоза + фруктоза = сахароза + вода; ΔG0р-я = +21 кДж.
Это эндэргоническая реакция, т.к. ΔGoр-я > 0. Она сопряжена с экзэргонической реакцией:
АТФ + Н2О = АДФ + Н3РО4; ΔGoр-я = ‑30,5 кДж.
В таблице 1 показана возможность (или невозможность) самопроизвольного протекания реакции при различных сочетаниях знаков DH и DS.
Таблица 1. Направление протекания реакций при различных знаках DH и DS.
| Знак изменения функции | Возможность (невозможность) самопроизвольного протекания реакции | Пример реакции | ||
| DH | DS | DG | ||
| - | + | - | Возможно при любых температурах | C6H6 + 7,5O2 = 6CO2 + 3H2O |
| + | - | + | Невозможно при любых температурах | N2 + 2O2 = 2NO2 |
| - | - | ± | Возможно при достаточно низких температурах | 3H2 + N2 = 2NH3 |
| + | + | ± | Возможно при достаточно высоких температурах | N2O4 = 2NO2 |
Развитие растений и животных происходит самопроизвольно, сопровождается образованием более сложных структур и, следовательно, приводит к уменьшению энтропии, ΔS < 0. Это возможно только потому, что неограниченно используется энергия Солнца, и энтальпийный фактор преодолевает противодействующий развитию энтропийный фактор.
Биоэнергетика
В процессе жизнедеятельности организм человека получает и расходует энергию. Даже в состоянии покоя организм взрослого человека расходует около 6000 кДж теплоты в сутки, что компенсируется энергией от принимаемой пищи. Эта минимальная энергия метаболизма сопоставима с энергией электрической лампочки мощностью 70 Вт.
Любое движение организма, любая работа, даже пищеварение, усиливают выделение тепла. Так, при лёгкой физической работе человеку необходимо 8400-12000 кДж в сутки, а при тяжелой - 16700-20900 кДж в сутки.
Установлено, что при окислении 1 г основных питательных веществ выделяются следующие количества теплоты: жиров - 39,5 кДж, углеводов - 17,1 кДж, белков - 22,3 кДж.
Для поддержания энергетического баланса человеку требуется количество энергии, равное отданной теплоте. Зная состав отдельных питательных веществ и их энтальпии сгорания, можно рассчитать количество необходимых для питания человека продуктов. При избыточном или нерациональном потреблении питательных веществ часть продуктов не усваивается и откладывается организмом в депо в виде жировой подкожной клетчатки, вызывая ожирение.
Рассмотрим в качестве примера ситуационную задачу.
Ситуационная задача №1
Дама, соблюдающая фигуру, на вечеринке не удержалась и съела в составе торта 40 г жиров и 60 г углеводов. Рассчитать количество энергии, которое выделится в организме этой женщины, и время, в течение которого дама должна заниматься аэробикой, чтобы скомпенсировать излишества. Расход энергии при занятиях аэробикой составляет 1420 кДж/час.
Решение.
Общее количество энергии (теплоты), выделившейся в организме этой женщины, равно:
40×39,5 + 60×17,1 = 2606 кДж.
Поделив количество энергии на расход, получим:
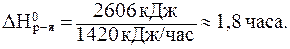
Ответить на этот вопрос можно и при помощи следствий из закона Гесса. Если считать условия в организме человека близкими к стандартным, а окисление углеводов (например, глюкозы) предельным и протекающим по уравнению:
С6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.),
то согласно I следствию из закона Гесса:
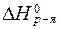 = (6×
= (6× 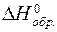 CO2 + 6×
CO2 + 6×  H2O) -
H2O) -  С6H12O6 =
С6H12O6 =
= (6×(-394) + 6×(-286)) - (-1274) = -2806 кДж/моль.
Стандартное значение энтальпии реакции соответствует превра-щению 1 моль вещества. В случае, когда превращению подвергается иное количество вещества, энтальпия реакции равна:
DH = n×DH0,
где n - количество вещества.
В данном случае количество глюкозы равно:
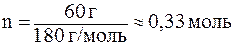 ,
,
а количество энергии (энтальпия реакции):
DH = 0,33×(-2806) » -926 кДж.
Аналогичным образом можно рассчитать и энергию, полученную организмом в результате предельного окисления жиров и белков.
Главным источником энергии для многих биологических процессов - от биосинтеза белка и ионного транспорта до сокращения мышц и электрической активности нервных клеток - является реакция гидролиза АТФ:
АТФ + H2O = АДФ + Н3РО4; DG0 = -30,5 кДж/моль
Эта реакция является экзэргонической, при стандартных условиях протекает в прямом направлении с выделением энергии.
В некоторых случаях возможно протекание в прямом направлении и эндэргонических реакций. Так, реакция прямого фосфорилирования глюкозы с образованием глюкозо-6-фосфата является эндэргонической:
1) Глюкоза + Н3РО4 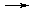 Глюкозо-6-фосфат + Н2О;
Глюкозо-6-фосфат + Н2О;
ΔG0 = +13,8 кДж/моль
Для протекания такой реакции в прямом направлении необходимо её сопряжение с экзэргонической реакцией (2), величина свободной энергии которой по модулю больше, чем требуется для фосфорилирования глюкозы:
2) АТФ + H2O 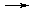 АДФ + Н3РО4 ΔG0 = -30,5 кДж/моль.
АДФ + Н3РО4 ΔG0 = -30,5 кДж/моль.
При сопряжении процессов (1) и (2) фосфорилирование глюкозы легко протекает в физиологических условиях:
3) Глюкоза + АТФ  Глюкозо-6-фосфат + АДФ
Глюкозо-6-фосфат + АДФ
ΔG0 = -16,7 кДж/моль.
Примеры решения задач
Задача №1
Некоторая реакция протекает с уменьшением энтропии. Определить, при каком условии возможно самопроизвольное протекание данной реакции.
Решение.
Условием самопроизвольного протекания реакции является уменьшение свободной энергии Гиббса, т.е. DG < 0. Изменение DG можно рассчитать по формуле:
DG = DH - T×DS
Так как в ходе реакции энтропия уменьшается (DS < 0), то энтропийный фактор препятствует самопроизвольному протеканию данной реакции. Таким образом, самопроизвольное протекание данной реакции может обеспечить только энтальпийный фактор. Для этого необходимо выполнение следующих условий:
1) DH < 0 (реакция экзотермическая);
2) 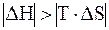 .
.
Задача №2
Эндотермическая реакция разложения протекает самопроиз-вольно. Оценить изменение энтальпии, энтропии и величины свободной энергии Гиббса.
Решение.
1) Так как реакция эндотермическая, то DH > 0.
2) В реакциях разложения энтропия возрастает, следовательно DS > 0.
3) Самопроизвольное протекание реакции означает, что DG < 0.
Задача №3
Вычислить стандартную энтальпию хемосинтеза, протекающего в бактериях Thiobacillus denitrificans:
6KNO3(тв.) + 5S(тв.) + 2CaCO3(тв.) = 3K2SO4(тв.) + 2CaSO4(тв.) + 2CO2(газ) + 3N2(газ)
по значениям стандартных энтальпий образования веществ:
| K2SO4 | CaSO4 | CO2 | KNO3 | CaCO3 | |
 , кДж/моль , кДж/моль | -1438 | -1432 | -393,5 | -493 | -1207 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
Решение.
Запишем выражение первого следствия из закона Гесса с учетом того, что стандартные энтальпии образования серы и азота равны нулю:
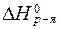 = (3×
= (3×  K2SO4 + 2×
K2SO4 + 2×  CaSO4 + 2×
CaSO4 + 2×  CO2) -
CO2) -
- (6×  KNO3 + 2×
KNO3 + 2×  CaCO3) = 3×(-1438) + 2×(-1432) +
CaCO3) = 3×(-1438) + 2×(-1432) +
+ 2×(-393,5) - [6×(-493) + 2×(-1207)] = -2593 кДж.
Так как 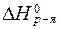 < 0, то реакция экзотермическая.
< 0, то реакция экзотермическая.
Задача №4
Вычислить стандартную энтальпию реакции:
2C2H5OH(жидк.) = C2H5OC2H5(жидк.) + H2O(жидк.)
по значениям стандартных энтальпий сгорания веществ:
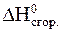 C2H5OH = -1368 кДж/моль;
C2H5OH = -1368 кДж/моль;
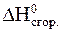 C2H5OC2H5 = -2727 кДж/моль.
C2H5OC2H5 = -2727 кДж/моль.
Решение.
Запишем выражение второго следствия из закона Гесса с учётом того, что стандартная энтальпия сгорания воды (высший оксид) равна нулю:
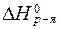 = 2×
= 2× 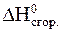 C2H5OH -
C2H5OH - 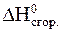 C2H5OC2H5 =
C2H5OC2H5 =
= 2× (-1368) - (-2727) = -9 кДж.
Следствия из закона Гесса позволяют вычислять не только стандартные энтальпии реакций, но и величины стандартных энтальпий образования и сгорания веществ по косвенным данным.
Задача №5
Определить стандартную энтальпию образования оксида углерода (II) по следующим данным:
| (1) | C(тв.) + О2(газ) = СО2(газ); | 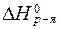 = -393,5 кДж/моль; = -393,5 кДж/моль; |
| (2) | СО(газ) + 0,5О2(газ) = СО2(газ); | 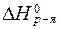 = -283,0 кДж/моль. = -283,0 кДж/моль. |
Решение.
Из уравнения (1) видно, что стандартное изменение энтальпии данной реакции соответствует стандартной энтальпии образования CO2.
Запишем выражение первого следствия из закона Гесса для реакции (2):
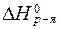 =
=  CO2 -
CO2 -  CO.
CO.
Отсюда:
 CO =
CO =  CO2 -
CO2 - 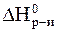 .
.
Подставим значения и получим:
 CO = -293,5 - (-283) = -110,5 кДж/моль.
CO = -293,5 - (-283) = -110,5 кДж/моль.
Эту задачу можно решить и другим способом.
Вычитая из первого уравнения второе, получим:
| (1) - (2) | C(тв.) + 0,5О2(газ) = СО(газ); |  CO = -110,5 кДж/моль. CO = -110,5 кДж/моль. |
Задача №6
Вычислить стандартную энтропию реакции:
CH4(газ) + Cl2(газ) = CH3Cl(газ) + HCl(газ),
по значениям стандартных энтропий веществ:
| CH3Cl | HCl | CH4 | Cl2 | |
 , Дж/(моль×K) , Дж/(моль×K) |
Решение.
Стандартную энтропию реакции вычислим по формуле (17):
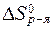 = (
= (  CH3Cl +
CH3Cl +  HCl) - (
HCl) - (  CH4 +
CH4 +  Cl2) = 234 + 187 - (186 +
Cl2) = 234 + 187 - (186 +
+ 223) = 12 Дж/(моль×K).
Задача №7
Вычислить стандартную энергию Гиббса реакции:
C2H5OH(жидк.) + H2O2(жидк.) = CH3COH(газ) + 2H2O(жидк.)
по следующим данным:
| CH3COH | C2H5OH | H2O | H2O2 | |
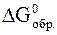 , кДж/моль , кДж/моль | -128 | -175 | –237 | –121 |
Определить, возможно ли самопроизвольное протекание данной реакции при стандартных условиях.
Решение.
Стандартную энергию Гиббса реакции вычислим по формуле (18):
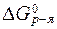 = (
= ( 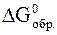 CH3COH + 2×
CH3COH + 2× 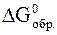 H2O) - (
H2O) - ( 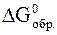 C2H5OH +
C2H5OH + 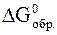 H2O2) = -128 + 2× (-237) - [(-175) + (-121)] = -306 кДж/моль.
H2O2) = -128 + 2× (-237) - [(-175) + (-121)] = -306 кДж/моль.
Так как 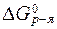 < 0, то самопроизвольное протекание данной реакции возможно.
< 0, то самопроизвольное протекание данной реакции возможно.
Задача №8
Рассчитать стандартную энергию Гиббса для реакции окисления глюкозы:
С6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.).
по известным данным:
| H2O | CO2 | С6H12O6 | O2 | |
 , кДж/моль , кДж/моль | -286 | -393,5 | –1274,5 | |
 , Дж/(моль×K) , Дж/(моль×K) |
Решение.
Значения стандартных энтальпии и энтропии реакции рассчитаем при помощи первого следствия из закона Гесса:
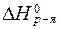 = 6×
= 6×  CO2 + 6×
CO2 + 6×  H2O -
H2O -  С6H12O6 - 6
С6H12O6 - 6  O2 =
O2 =
= 6×(-393,5) + 6×(-286) - (-1274,5) - 6×0 = -2803 кДж;
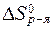 = 6×
= 6×  СО2 + 6×
СО2 + 6×  H2O -
H2O -  С6H12O6 - 6×
С6H12O6 - 6×  O2 =
O2 =
= 6×214 + 6×70 - 212 - 6×205 = 262 Дж/K = 0,262 кДж/K.
Стандартную энергию Гиббса реакции найдем из соотношения:
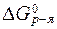 =
= 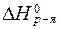 - T×
- T× 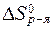 = -2803 кДж - 298,15 K×0,262 кДж/K =
= -2803 кДж - 298,15 K×0,262 кДж/K =
= -2881 кДж.
Задача №9
Вычислить стандартную энергию Гиббса реакции гидратации сывороточного альбумина при 250С, для которой DH0 = -6,08 кДж/моль; DS0 = -5,85 Дж/(моль×K). Оценить вклад энтальпийного и энтропийного фактора.
Решение.
Стандартную энергию Гиббса реакции рассчитаем по формуле:
DG0 = DH0 - T×DS0.
Подставив значения, получим:
DG0 = -6,08 кДж/моль - 298 K×(-5,85×10-3) кДж/(моль×K) =
= -4,34 кДж/моль.
В данном случае энтропийный фактор препятствует протеканию реакции, а энтальпийный - способствует. Самопроизвольное протекание реакции возможно при условии, если 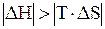 , т.е., при низких температурах.
, т.е., при низких температурах.
Задача №10
Определить температуру, при которой самопроизвольно пойдет реакция денатурации трипсина, если 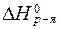 = 283 кДж/моль,
= 283 кДж/моль, 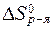 = 288 Дж/(моль×K).
= 288 Дж/(моль×K).
Решение.
Температуру, при которой равновероятны оба процесса найдём из соотношения:
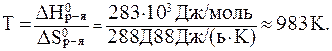
В данном случае энтальпийный фактор препятствует протеканию реакции, а энтропийный - способствует. Самопроизвольное проте-кание реакции возможно при условии, если:
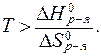
Таким образом, условием самопроизвольного протекания процесса является T > 983 K.
Вопросы для самоконтроля
1. Что такое термодинамическая система? Какие типы термодина-мических систем вы знаете?
2. Перечислите известные Вам термодинамические параметры. Какие из них относятся к измеряемым? Какие к неизмеряемым?
3. Что такое термодинамический процесс? Как называются процессы, протекающие при постоянстве одного из параметров?
4. Какие процессы называют экзотермическими? Какие эндотер-мическими?
5. Какие процессы называют обратимыми? Какие необратимыми?
6. Что понимают под термином «состояние системы»? Какие бывают состояния системы?
7. Какие системы изучает классическая термодинамика? Сформулируйте первый и второй постулаты термодинамики.
8. Какие переменные называют функциями состояния? Перечислите известные вам функции состояния.
9. Что такое внутренняя энергия? Можно ли измерить внутрен-нюю энергию?
10. Что такое энтальпия? Какова её размерность?
11. Что такое энтропия? Какова её размерность?
12. Что такое свободная энергия Гиббса? Как её можно вычислить? Что можно определить при помощи этой функции?
13. Какие реакции называют экзэргоническими? Какие эндэрго-ническими?
14. Сформулируйте первый закон термодинамики. В чем заключается эквивалентность теплоты и работы?
15. Сформулируйте закон Гесса и следствия из него. Что такое стандартная энтальпия образования (сгорания) вещества?
16. Сформулируйте второй закон термодинамики. Какие процессы самопроизвольно протекают в изолированной системе?
Варианты задач для самостоятельного решения
Вариант № 1
1. Вычислить стандартную энтальпию реакции хемосинтеза, протекающую в бактериях Nitrosomonas:
NH3(газ) + 1,5O2(газ) = HNO2(р-р) + H2O(жидк.),
используя значения стандартных энтальпий образования веществ:
| NH3 | HNO2 | H2O | |
 , кДж/моль , кДж/моль | -46 | -119 | -286 |
Экзо- или эндотермической является эта реакция?
2. Вычислить стандартную энтальпию и энтропию реакции:
С2H6(газ) + H2(газ) = 2CH4(газ),
используя следующие значения:
| C2H6 | CH4 | H2 | |
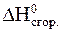 , кДж/моль , кДж/моль | -1560 | -890 | -286 |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Вычислить стандартную энергию Гиббса реакции гидратации b-лактоглобулина при 250С, для которой DH0 = -6,75 кДж, DS0 = -9,74 Дж/K. Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №2
1. Вычислить стандартную энтальпию реакции окисления твёрдого глицина:
NH2CH2COOH(тв) + 1,5O2(газ) = 2СO2(газ) + H2O(жидк.) + NH3(газ),
используя значения стандартных энтальпий образования веществ:
| NH2CH2COOH | СO2 | H2O | NH3 | |
 , кДж/моль , кДж/моль | -537 | -394 | -286 | -46 |
Экзо- или эндотермической является эта реакция?
2. Вычислить стандартную энтальпию и энергию Гиббса реакции:
С2H2(газ) + 2H2(газ) = C2H6(газ),
используя следующие значения:
| C2H2 | C2H6 | H2 | |
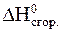 , кДж/моль , кДж/моль | -1300 | -1560 | -286 |
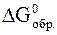 , кДж/моль , кДж/моль | -33 |
3. Вычислить стандартную энергию Гиббса реакции тепловой денатурации химотрипсиногена при 500С, для которой DH0 = 417 кДж, DS0 = 1,32 кДж/K. Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №3
1. Рассчитать массу углеводов, необходимую для того, чтобы восполнить потерю энергии в 3000 кДж. Считать, что окисление углеводов в организме является предельным и протекает по уравнению:
С12H22O11(р-р) + 12O2(газ) = 12CO2(газ) + 11H2O(жидк.),
если:
| С12H22O11(р-р) | CO2(газ) | H2O(жидк.) | |
 , кДж/моль , кДж/моль | -2215 | -394 | -286 |
2. Вычислить стандартную энтальпию реакции гидрирования бензола до циклогексана двумя способами, т.е., используя значения стандартных энтальпий образования и сгорания веществ:
| C6H6 | C6H12 | H2 | |
 , кДж/моль , кДж/моль | -156 | ||
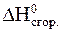 , кДж/моль , кДж/моль | -3268 | -3920 | -286 |
Экзо- или эндотермической является эта реакция?
3. Оценить возможность самопроизвольного протекания реакции превращения пировиноградной кислоты в уксусный альдегид и оксид углерода (IV):
CH3COCOOH(р-р) = CH3COH(газ) + CO2(газ)
при стандартных условиях, если:
| CH3COCOOH | CH3COH | CO2 | |
 , кДж/моль , кДж/моль | -596 | -166 | -394 |
 , Дж/(моль×K) , Дж/(моль×K) | 171,5 |
Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №4
1. Вычислить стандартную энтальпию хемосинтеза, протекаю-щего в автотрофных бактериях Beggiatoa и Thiothrix, по стадиям и суммарно:
2H2S(газ) + O2(газ) = 2H2O(жидк.) + 2S(тв.);
2S(тв.) + 3O2(газ) + 2H2O(жидк.) = 2H2SO4(жидк.),
если:
| H2S | H2O | H2SO4 | |
 , кДж/моль , кДж/моль | -20 | -286 | -814 |
2. Вычислить стандартную энтальпию и энтропию реакции:
3C2H2(газ) = C6H6(жидк.),
используя следующие данные:
| C2H2 | C6H6 | |
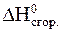 , кДж/моль , кДж/моль | -1300 | -3268 |
 , Дж/(моль×K) , Дж/(моль×K) |
Экзо- или эндотермической является эта реакция?
3. Оценить роль энтальпийного и энтропийного факторов для реакции гидролиза мочевины:
CO(NH2)2 (р-р) + Н2О(жидк.) = 2NH3 (р-р) + СО2 (р-р)
по известным данным:
| CO(NH2)2 | Н2О | NH3 | СО2 | |
 , кДж/моль , кДж/моль | -319 | -286 | -80 | -414 |
 , Дж/(моль×K) , Дж/(моль×K) |
Определить температуру, при которой реакция пойдет самопроизвольно.
Вариант №5
1. Вычислить стандартную энтальпию реакции окисления глицина в растворе:
2NH2CH2COOH(р-р) + 3O2(газ) = СO(NH2)2(р-р) + 3H2O(жидк.) + 3CO2(газ),
используя значения стандартных энтальпий образования веществ:
| NH2CH2COOH | H2O | СO(NH2)2 | CO2 | |
 , кДж/моль , кДж/моль | -523 | -286 | -319 | -394 |
Экзо- или эндотермической является эта реакция?
2. Вычислить стандартную энтальпию реакции:
С6H5NO2(жидк.) + 3H2(газ) = С6H5NH2(жидк.) + 2H2O(жидк.),
используя значения стандартных энтальпий сгорания веществ:
| С6H5NO2 | С6H5NH2 | H2 | |
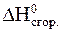 , кДж/моль , кДж/моль | -3093 | -3396 | -286 |
Экзо- или эндотермической является эта реакция?
3. Вычислить стандартную энергию Гиббса реакции денатурации трипсина при 500С, для которой DH0 = 283 кДж, DS0 = 288 Дж/K. Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №6
1. Вычислить стандартную энтальпию хемосинтеза, протекаю-щего в автотрофных бактериях Thiobacillus Thioparus:
5Na2S2O3×5H2O(тв.) + 7O2(газ) = 5Na2SO4(тв.) + 3H2SO4(ж.) + 2S(тв.) + 22H2O(ж.),
если:
| Na2S2O3×5H2O | Na2SO4 | H2SO4 | H2O | |
 , кДж/моль , кДж/моль | -2602 | -1389 | -814 | -286 |
Экзо- или эндотермической является эта реакция?
2. Вычислить стандартную энтальпию и энергию Гиббса реакции:
CH3COH(жидк.) + H2(газ) = C2H5OH(жидк.)
по следующим данным:
| CH3COH | C2H5OH | H2 | |
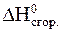 , кДж/моль , кДж/моль | -1166 | -1368 | -286 |
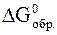 , кДж/моль , кДж/моль | -128 | -175 |
3. Определить возможность самопроизвольного протекания реакции гидролиза дипептида глицил-глицина:
NH2CH2CONHCH2COOH(р-р) + H2O(жидк.) = 2NH2CH2COOH(р-р)
глицил-глицин
при стандартных условиях, если:
| глицил-глицин | H2O(жидк.) | NH2CH2COOH | |
 , кДж/моль , кДж/моль | -734 | -523 | |
 , Дж/(моль×K) , Дж/(моль×K) |
Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №7
1. Вычислить стандартную энтальпию образования CH3OH по следующим данным:
CH3OH(жидк.) + 1,5O2(газ) = CO2(газ) + 2H2O(жидк.) DH0 = -726,5 кДж;
С(графит) + O2(газ) = CO2(газ) DH0 = -394 кДж;
H2(газ) + 0,5O2(газ) = H2O(жидк.) DH0 = -286 кДж.
2. Вычислить стандартную энтальпию сгорания сероуглерода CS2 по следующим данным:
CS2(жидк.) + 3O2(газ) = CO2(газ) + 2SO2(газ) DH0 = -1078 кДж;
SO2(газ) + 0,5O2(газ) = SO3(газ) DH0 = -98 кДж.
3. Вычислить DG0 процесса:
АТФ + аланин + глицин = АДФ + Н3РО4 + аланилглицин,
если известно:
АТФ + H2O = АДФ + Н3РО4 DG0 = –30,5 кДж/моль;
аланин + глицин = аланилглицин + H2O DG0 = 17,2 кДж/моль.
Определить направление протекания процесса.
Вариант №8
1. Вычислить значение DH0 для возможных реакций превращения глюкозы:
1) C6H12O6(р-р) = 2C2H5OH(р-р) + 2CO2(газ);
2) C6H12O6(р-р) = 2С3H6O3(р-р).
по известным данным:
| C6H12O6 | C2H5OH | CO2 | С3H6O3 | |
 , кДж/моль , кДж/моль | -1275 | -278 | -394 | -686 |
В результате какой из этих реакций выделяется большее количество энергии?
2. Вычислить стандартную энтальпию и энтропию реакции:
С3H6(газ) + H2(газ) = С3H8(газ),
используя следующие значения:
| C3H6 | С3H8 | H2 | |
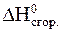 , кДж/моль , кДж/моль | -2058 | -2220 | -286 |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Оценить возможность самопроизвольного окисления хлороформа CHCl3 кислородом воздуха:
CHCl3 (газ) + O2(газ) = CO2(газ) + HCl (газ) + Cl2 (газ),
при стандартных условиях, если:
| CHCl3 | CO2 | HCl | O2 | Cl2 | |
 , кДж/моль , кДж/моль | -100 | -394 | -92 | ||
 , Дж/(моль×K) , Дж/(моль×K) |
Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №9
1. Вычислить стандартную энтальпию образования Ca3(PO4)2 по следующим данным:
3CaO(тв.) + P2O5(тв.) = Ca3(PO4)2(тв.) DH0 = -739 кДж;
P4(тв.) + 5O2(газ) = 2P2O5(тв.) DH0 = -2984 кДж;
Ca(тв.) + 0,5O2(газ) = CaO(тв.) DH0 = -636 кДж.
2. При растворении 49 г серной кислоты в 800 г воды температура раствора повысилась на 11,80С. Принимая удельную теплоёмкость раствора, равной 3,76 Дж/(г×K), рассчитать стандартную энтальпию растворения серной кислоты.
3. Оценить возможность самопроизвольного протекания реакции:
2CO(газ) + 2H2O(жидк) = CH3COOH(жидк) + O2(газ),
при стандартных условиях, если:
| CO | H2O | CH3COOH | O2 | |
 , кДж/моль , кДж/моль | -110 | -286 | -485 | |
 , Дж/(моль×K) , Дж/(моль×K) |
Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №10
1. Вычислить стандартную энтальпию образования этанола по следующим данным:
DH0сгор.C2H5OH(жидк.) = -1368 кДж/моль;
С(графит) + O2(газ) = CO2(газ) +394 кДж;
H2(газ) + 0,5O2(газ) = H2O(жидк.) +286 кДж.
2. Вычислить стандартную энтальпию и энергию Гиббса реакции:
C4H8(газ) + 2O2(газ) = 2CH3COOH(жидк.)
по следующим данным:
| C4H8 | CH3COOH | O2 | |
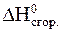 , кДж/моль , кДж/моль | -2710 | -875 | |
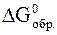 , кДж/моль , кДж/моль | -390 |
3. Вычислить стандартную энергию Гиббса реакции гидратации яичного альбумина при 250С, для которой DH0 = -6,58 кДж/моль, DS0 = -9,5 Дж/(моль×К). Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №11
1. Вычислить стандартную энтальпию реакции:
4NH3(газ) + 5O2(газ) = 4NO(газ) + 6H2O(газ),
используя значения стандартных энтальпий образования веществ:
| NH3 | NO | H2O | |
 , кДж/моль , кДж/моль | -46 | -242 |
Экзо- или эндотермической является эта реакция?
2. В организме человека окисление этанола протекает в две стадии:
1) C2H5OH(р-р) + 0,5O2(газ) = CH3COH(р-р) + H2O(жидк.) DH0 = -256 кДж;
2) CH3COH(р-р) + 0,5O2(газ) = CH3COOH(р-р) DH0 = -237 кДж.
Рассчитать стандартную энтальпию прямого превращения этанола в уксусную кислоту.
3. При 370C величины DH0 и DG0 для гидролиза АТФ равны соответственно +24,3 и -30,5 кДж/моль. Вычислить стандартную энтропию этой реакции и определить температуру, при которой возможен данный процесс.
Вариант №12
1. В ходе реакции окисления аммиака
4NH3(газ) + 3O2(газ) = 2N2(газ) + 6H2O(жидк.)
образовалось 2,24 л азота и при этом выделилось 76,5 кДж теплоты. Вычислить 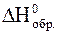 NH3, если
NH3, если 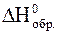 H2O = -286 кДж/моль.
H2O = -286 кДж/моль.
2. Вычислить стандартную энтальпию и энтропию реакции:
СO(газ) + 3H2(газ) = СH4(газ) + H2O(газ),
используя следующие значения:
| СO | СH4 | H2 | H2O | |
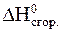 , кДж/моль , кДж/моль | -284 | -890 | -286 | |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Определить направление протекания процесса:
D-глюкоза + АТФ = D-фруктоза-6-фосфат + АДФ,
если для реакции:
D-глюкоза + АТФ = D-глюкоза-6-фосфат + АДФ
величина DG0 равна –16,7 кДж/моль, а для сопряжённой с ней реакции:
D-глюкоза-6-фосфат = D-фруктоза-6-фосфат
DG0 составляет +1,7 кДж/моль.
Вариант №13
1. Вычислить стандартную энтальпию реакции:
4L-аланин(р-р) + 15O2 газ = 12CO2 газ + 14H2O(жидк.) + 2N2 газ
используя значения стандартных энтальпий образования веществ:
| L-аланин | CO2 | H2O | |
 , кДж/моль , кДж/моль | -563 | -394 | -286 |
Экзо- или эндотермической является эта реакция?
2. Вычислить стандартную энтальпию и энергию Гиббса реакции:
CH4(газ) + CO2(газ) = 2CO(газ) + 2H2(газ)
по следующим данным:
| CH4 | CO2 | CO | H2 | |
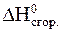 , кДж/моль , кДж/моль | -890 | -284 | -286 | |
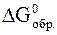 , кДж/моль , кДж/моль | -51 | -394 | -137 |
3. Определить, возможен ли метаболизм глюкозы в следующем направлении при 370С:
C6H12O6(р-р) = C3H7COOH(р-р) + 2CO2(газ) + 2H2(газ)
если:
| C6H12O6 | CO2 | C3H7COOH | H2 | |
 , кДж/моль , кДж/моль | -1264 | -524 | ||
 , Дж/(моль×K) , Дж/(моль×K) |
Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой возможен данный процесс.
Вариант №14
1. Вычислить стандартную энтальпию предельного окисления лимонной кислоты:
C6H8O7(р-р) + 5O2 газ = 12CO2 газ + 14H2O(жидк.)
используя значения стандартных энтальпий образования веществ:
| C6H8O7 | CO2 | H2O | |
 , кДж/моль , кДж/моль | -1838 | -394 | -286 |
Экзо- или эндотермической является эта реакция?
2. Вычислить стандартную энтальпию и энтропию реакции:
CO(газ) + 2H2(газ) = CH3OH(жидк.),
используя следующие значения:
| СO | H2 | CH3OH | |
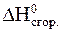 , кДж/моль , кДж/моль | -284 | -286 | -726 |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Для некоторой реакции DS0 = -100 Дж/(моль×K); DH0 = -50 кДж/моль. Определить направление протекания процесса при 2270С. Оценить вклад энтальпийного и энтропийного фактора. Определить температуру, при которой данный процесс будет протекать в прямом направлении.
Вариант №15
1. Для затвердевания пломбировочных материалов используют реакцию:
3MgO(тв.) + 2H3PO4(р-р) = Mg3(PO4)2 (тв.) + 3H2O(жидк.)
Вычислить стандартную энтропию реакции, используя значения стандартных энтальпий образования веществ:
| MgO | H3PO4 | Mg3(PO4)2 | H2O | |
 , кДж/моль , кДж/моль | -602 | -1277 | -3384 | -286 |
Экзо- или эндотермической является эта реакция?
2. Вычислить стандартную энтальпию и энтропию реакции:
2C2H5OH(жидк.) = C4H6(газ) + 2H2O(жидк.) + H2(газ)
используя следующие значения:
| C4H6 | C2H5OH | H2 | H2O | |
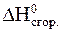 , кДж/моль , кДж/моль | -2544 | -1368 | -286 | |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Определить, возможен ли при стандартных условиях процесс самопроизвольного затвердевания гипса:
CaSO4(тв.) + 2H2O(жидк.) = CaSO4×2H2O(тв.)
если:
| CaSO4 | CaSO4×2H2O | H2O | |
 , кДж/моль , кДж/моль | -1432 | -1762 | -286 |
 , Дж/(моль×K) , Дж/(моль×K) |
Оценить вклад энтальпийного и энтропийного фактора.Определить температуру, при которой данный процесс будет протекать в прямом направлении.
Вариант №16
1. Предельное окисление L-глутаминовой кислоты происходит по уравнению:
4С5H9O4N(р-р) + 21O2 (газ) = 20CO2 (газ) + 18H2O(жидк.) + 2N2 (газ)
Вычислить стандартную энтропию реакции, используя значения стандартных энтальпий образования веществ:
| С5H9O4N | CO2 | H2O | |
 , кДж/моль , кДж/моль | -982 | -394 | -286 |
Экзо- или эндотермической является эта реакция?
2. Вычислить стандартную энтальпию и энергию Гиббса реакции:
C4H8(газ) + H2(газ) = C4H10(газ)
по следующим данным:
| C4H10 | C4H8 | H2 | |
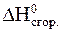 , кДж/моль , кДж/моль | -2878 | -2717 | -286 |
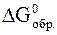 , кДж/моль , кДж/моль | -17 |
3. Вычислить стандартную энтропию реакции фотосинтеза с образованием сахарозы, для которой DG0 = 4508 кДж/моль; DH0 = 5659 кДж/моль. Оценить вклад энтальпийного и энтропийного фактора.Определить температуру, при которой данный процесс будет протекать в прямом направлении.
Вариант №17
1. Образование мочевины в организме происходит по уравнению:
2NH3×Н2О (р-р) + СО2 (газ) = CO(NH2)2 (раствор) + 3Н2О (жидк.)
Вычислить стандартную энтальпию реакции, используя значения стандартных энтальпий образования веществ:
| NH3×Н2О | СО2 | CO(NH2)2 | Н2О | |
 , кДж/моль , кДж/моль | -264 | -394 | -197 | -286 |
Экзо- или эндотермической является эта реакция?
2. Стандартные энтальпии растворения CuSO4, CuSO4×H2O, CuSO4×5H2O равны соответственно: -67; -39; +12 кДж/моль. Вычислить значения стандартной энтальпии процессов перехода CuSO4 в обе гидратные формы.
3. Определить направление протекания процесса:
креатинфосфат + АДФ = креатин + АТФ,
если:
креатинфосфат + H2O = креатин + Н3РО4; DG0 = –43 кДж/моль;
АТФ + H2O = АДФ + Н3РО4; DG0 = –30,5 кДж/моль.
Вариант №18
1. Вычислить стандартную энтальпию реакции гидролиза тристеарата, протекающей по уравнению:
C54H110O6 (р-р) + 3H2O (жидк.) = 3C17H35COOH (р-р) + C3H8O3 (р-р),
если известно: 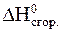 (C54H110O6) = -37760 кДж/моль;
(C54H110O6) = -37760 кДж/моль;  (CO2) = -394 кДж/моль;
(CO2) = -394 кДж/моль;  (H2O) = -286 кДж/моль;
(H2O) = -286 кДж/моль;  (C17H35COOH) = -949 кДж/моль;
(C17H35COOH) = -949 кДж/моль;  ( C3H8O3) = -669 кДж/моль.
( C3H8O3) = -669 кДж/моль.
2. Вычислить стандартную энтальпию образования аммиака, если известно:
4NH3(газ) + 3O2(газ) = 2N2(газ) + 6H2O(газ) + 1226 кДж;
2H2(газ) + O2(газ) = 2H2O(газ) + 484 кДж.
3. Мужчина, соблюдающий фигуру, на вечеринке не удержался и выпил 50 мл водки (40%-й раствор этанола в воде плотностью 0,94 г/мл). Рассчитать количество энергии, которое выделится в организме мужчины, если стандартная энтальпия сгорания этанола составляет -1368 кДж/моль. Определить время, в течение которого он должен заниматься на велотренажёре, чтобы компенсировать излишества, если расход энергии составляет 2100 кДж/час.
