Особенности работы в биохимической лаборатории
Студенты знакомятся с правилами проведения занятий и правилами работы в биохимической лаборатории.
Инструктаж по технике безопасности
Студенты знакомятся с инструкциями по технике безопасности и пожаробезопасности, получают дополнительный инструктаж от преподавателя и расписываются в журнале техники безопасности.
Лабораторные работы
Лаборатоpная работа. Устройства и приборы, применяемые в биохимической лаборатории. Правила работы с ними.
Студенты под руководством преподавателя знакомятся с проведением исследований в биохимической лаборатории, а также с правилами пользования пипетками, центрифугой, термостатом, фотоэлектроколориметром и рефрактометром.
Работа с микропипетками включает ряд навыков и умений: сменять наконечник, правильно использовать 2 упора хода поршня (первый упор – для точного отмеривания заданного количества, второй упор – для внесения образца в пробирку или колбу). Перед внесением пробы убедиться, что в отобранном образце нет пузырьков воздуха. В пипетках с вариабельным объемом требуемый объем устанавливается путем вращения лимба с цифровым индикатором.
Рекомендуемая литература
Основная
1 Биохимия: Учебник для вузов / Под ред. Е.С. Северина. – 4-е изд., испр. – М.: ГЭОТАР-Медиа, 2006. – С. 69-73.
2 Филиппович, Ю. Б. Основы биохимии. – 4-е изд. – М.: Агар, 1999. – С. 15-22.
3 Марри, Р. и др. Биохимия человека: в 2-х т.: Пер. с англ., М.: Мир, 2004. – Т.1: С. 16-20.
Занятие 2
Строение и функции белков
Цель занятия: Изучить структуру и физико-химические свойства белков. Научиться определять содержание общего белка в плазме крови биуретовым методом.
Исходный уровень знаний и навыков
Студент должен знать:
1 Основные правила техники безопасности при работе в химической лаборатории.
2 Строение и классификацию альфа-аминокислот.
3 Кислотно-основные свойства аминокислот. Реакции на их функциональные группы.
4 Уровни структурной организации белка.
5 Особенности строения пептидной связи.
6 Качественные реакции на белки и пептиды.
7 Комплексные соединения (комплекс меди в биуретовой реакции).
Студент должен уметь:
1 Проводить качественные реакции на белки и пептиды.
Структура занятия
Теоретическая часть
1.1 Введение в биохимию. Краткая история биохимии. История отечественной биохимии. Общая характеристика обмена веществ. Понятие об анаболизме, катаболизме и метаболизме.
1.2 Белки – важнейшие компоненты организма. Функции белков, строение, классификация и свойства аминокислот. Обзор уровней структурной организации белковой молекулы. Молекулярная масса белков. Форма и размеры белковой молекулы.
1.3 Принципы определения структуры белка:
1.3.1 Кислотный гидролиз белка;
1.3.1.1 Разделение аминокислот с помощью ионообменной хроматографии;
1.3.1.2 Количественный анализ полученных фракций;
1.3.2 Определение аминокислотной последовательности в белках и олигопептидах;
1.3.2.1 Ферментативное расщепление пептидов (пепсином, трипсином, химотрипсином, папаином);
1.3.2.2 Химическое расщепление пептидов (бромцианом);
1.3.2.3 Определение С-концевых аминокислот (карбоксипептидазами);
1.3.2.4 Определение N-концевых аминокислот (дансил-хлоридом, динитрофторбензолом, фенилизотиоцианатом);
1.3.2.5 определение первичной структуры белка (аминокислотной последовательности);
1.3.2.6 методы пептидных карт («метод отпечатков пальцев»).
1.3.3 Изучение пространственной структуры белковой молекулы (вторичная, третичная, четвертичная структуры):
1.3.3.1 Рентгеноструктурный анализ.
1.3.3.2 Изучение трехмерных моделей белка (Protein Data Bank).
1.3.4 Представление о нативно-развернутых белках – функционально-активной форме белков в клетке.
Практическая часть
2.1 Решение задач.
2.2 Лабораторные работы.
2.3 Проведение контроля конечного уровня знаний.
Задачи
1 Рассмотрите указанные группы аминокислот и отметьте, какие из них являются гидрофобными:
а) тир, асп, глу; б) ала, лиз, сер; в) иле, лей, лиз; г) вал, лей, ала; д) арг, гли, цис?
2 Многие белки, содержащие 2 и более доменов, обнаруживают гомологию аминокислот. Эти белки образуются путем:
а) посттрансляционной модификации (процессинга); б) генетических изменений; в) дупликации генов и их слияния; г) аллостерической кооперации; д) транспептидных образований.
3 Остатки каких аминокислот в белках-гликопротеидах ковалентно связывают углеводы? Напишите пентапептид с этими аминокислотами (-ала-X-трп-Y-гли), где X и Y – названные аминокислоты.
4 Остатки каких аминокислот в белках-гистонах обладают положительным зарядом? Напишите пентапептид с этими аминокислотами (-ала-X-мет-Y-гли), где X и Y ‑ названные аминокислоты.
5 К фибриллярным белкам относятся:
а) альбумины; б) гистоны; в) коллагены; г) глобулины.
Лабораторные работы
Лабораторная работа. Количественное определение общего белка в сыворотке крови биуретовым методом (УИРС)
ВНИМАНИЕ! Соблюдать меры безопасности при работе с раствором гидроксида натрия.
Принцип метода. В щелочной среде пептидные связи белка образуют с ионами двухвалентной меди комплекс фиолетового цвета (см. уравнение). Интенсивность окраски раствора прямо пропорциональна концентрации белка, определяемой фотометрически.
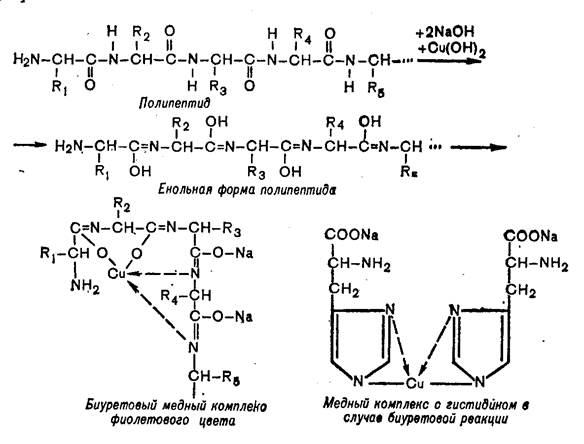
Ход работы. В пробирку наливают 0,05 мл сыворотки крови, затем добавляют 2,5 мл биуретового реактива. Содержимое пробирки осторожно перемешивают, избегая пенообразования, и через 30 мин фотометрируют в кюветах 5 мм при 540 нм (зеленый светофильтр) против контрольного раствора (дистиллированная вода). Измерив экстинкцию исследуемого раствора, по калибровочной кривой определяют концентрацию белка.

Клинико-диагностическое значение. Нормальное содержание белка в сыворотке крови у взрослых людей – 65–85 г/л, у детей – 58–85 г/л.
Повышенное содержание белка в сыворотке крови (гиперпротеинемия) встречается сравнительно редко. Прежде всего, при сгущении крови из-за значительных потерь внеклеточной жидкости, например, при усиленном потоотделении, неукротимой рвоте, профузных поносах (диареи), несахарном диабете, холере, обширных ожогах. Кратковременная относительная гиперпротеинемия отмечается также при ревматизме и миеломной болезни.
Снижение уровня белка в крови (гипопротеинемия) наблюдается при длительном голодании, нефритах, злокачественных опухолях, тяжелых гнойных процессах, обширных ожогах и др.
Выводы.Записать полученный результат и дать его клинико-диагностическую оценку.
____________________________________________________________________
_
_
_
_
Рекомендуемая литература
Основная
1 Кухта, В.К и др. Биологическая химия: учебник / В.К. Кухта, Т.С. Морозкина, Э.И. Олецкий, А.Д. Таганович; под ред. А.Д. Тагановича. – Минск: Асар, М.: Издательство БИНОМ, 2008. – С. 3-4, 7-40.
2 Биохимия: Учебник для вузов / Под ред. Е.С. Северина. – 4-е изд., испр. – М.: ГЭОТАР-Медиа, 2006. – С. 9-69.
3 Филиппович, Ю. Б. Основы биохимии. – 4-е изд. – М.: Агар, 1999. – С. 5-14, 23-78.
4 Николаев, А.Я. Биологическая химия. М.: Медицинское информационное агентство, 2004. – С. 24-60.
5 Марри, Р. и др. Биохимия человека: в 2-х т.: Пер. с англ., М.: Мир, 2004. – Т.1: С. 16-19, 42-51.
6 Березов, Т. Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – С. 19-77.
Дополнительная
7 Ленинджер, А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 107–225.
8 Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия. М.: Медицина, 1991. С. 313–376.
9 Албертс Б. и др. Молекулярная биология клетки, М.: Мир, 1994. Т. 1. С. 113–171.
Раздел 2 Энзимология и биологическое окисление
Занятие 3
Ферменты-1. Строение и функции белков.
Строение, свойства, номенклатура и классификация ферментов.
Цель занятия: закрепить знания по структуре белков, сформировать представления о строении и свойствах, номенклатуре и классификации ферментов. Научиться выполнять качественные реакции на аминокислоты и пептиды.
