Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков.
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента.
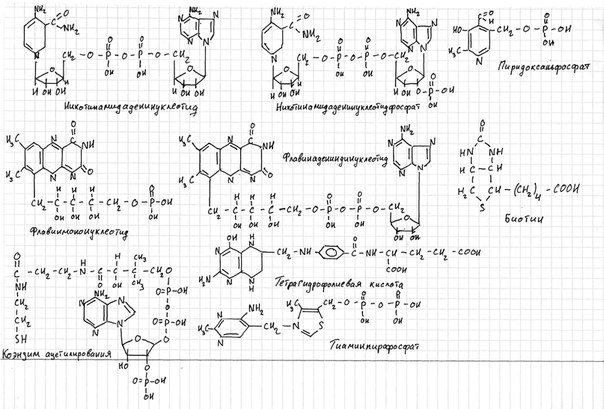
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата.
К коферментам относят:
 производные витаминов;
производные витаминов;
 нуклеотиды АТФ, УТФ, ЦТФ;
нуклеотиды АТФ, УТФ, ЦТФ;
 Фосфоаденозинфосфосульфат (ФАФС);
Фосфоаденозинфосфосульфат (ФАФС);
 НS-глутатион;
НS-глутатион;
 S-аденозилметионин (SAM);
S-аденозилметионин (SAM);
 гем;
гем;
 липоевая кислота и т.д.
липоевая кислота и т.д.
ВОПРОС № 35
Нередко в качестве коферментов выступают производные витаминов.
Например, витамин B6 – во всех своих формах используется для синтеза коферментов – пиридоксальфосфата и пиридоксаминофосфата. Ферменты, имеющие в своем составе эти коферменты, играют ключевую роль в обмене аминоксилот: катализируют реакции трансаминирования и декарбоксилирования аминокислот, участвуют в специфических реакциях метаболизма отдельных аминокислот: серина, треонина, триптофана, серосодержащих аминокислот, а также в синтезе гемма. Среди этих ферментов – трансаминазы.
Витамин РР – никотиновая кислота, никотинамид. Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ (группа ферментов из класса оксидоредуктаз, катализирующих перенос протонов от субстрата (органических веществ) и пары электронов — к акцептору).
Витамин В2(рибофлавин).В слизистой оболочке кишечника после всасывания витамина происходит образование коферментов FMN и FAD. Коферменты FAD и FMN входят в состав флавиновых ферментов, принимающих участие в окислительно-восстановительных реакциях.
ВОПРОС № 36
1) НАД и НАДФ – витамин РР. Перенос протонов и электронов от окисляемых веществ.
2) ФМН и ФАД – витамин В2. Перенос протонов и электронов от окисляемых веществ
3) ПФ – витамин В6. Перенос аминогрупп, декарбоксилирование аминокислот
4) Биотин – витамин Н. Связывание углекислого газа.
5) ТПФ – витамин В1. Декарбоксилирование альфа-кетокислот
6) ТГФК – витамин Вс. Транспорт одноуглеродных фрагментов
7) Коэнзим А – витамн В5. Активация и перенос ацильных групп, активация жирных кислот, синтез холестерина и кетоновых тел
ВОПРОС № 37
Каждый фермент имеет 2 названия. Первое - короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента.
В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, липаза, или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза. Есть и тривиальные названия – песин, трипсин.
Систематическая (рациональная) номенклатура – название S или субстратов, тип катализируемой реакции и окончание «аза». Например, D-глицеральдегид-3-фосфат: NAD-оксидоредуктаза (рабочее название - глицеральдегидфосфат дегидрогеназа). Из названия фермента следует, что субстратом этого фермента служит D-глицеральдегид-3-фосфат, тип катализируемой реакции - окислительно-восстановительная в присутствии кофермента NAD+.
Каждый фермент имеет кодовый номер (шифр) по классификации ферментов (КФ).
Код каждого Е имеет 4 цифры, разделенные точками.
 1 - номер класса,
1 - номер класса,
 2 – подкласс,
2 – подкласс,
 3 – подподкласс,
3 – подподкласс,
 4 цифра - порядковый номер фермента в его подподклассе.
4 цифра - порядковый номер фермента в его подподклассе.
Классы ферментов
1) Оксидоредуктазы — катализируют окислительно-восстановительные реакции с участием двух субстратов (перенос еˉ и атомов Н с одного S на другой). ЛДГ, сукцинатдегидрогеназа.
2) Трансферазы — перенос функциональных групп с одного соединения к другому. В подкласс фосфотрансфераз входит группа Е, называемых киназами, они используют АТФ в качестве донора фосфатного остатка. Аминотрансферазы, метилстрансферазы, гексокиназа, пируваткиназа
3) Гидролазы — катализируют реакции расщепления ковалентных связей с присоединением воды по месту расщепления. Амилаза, сахараза, пепсин, трипсин, липаза.
4) Лиазы — отщепляют от S негидролитическим путем определенную группу (СО2 Н2О) или присоединяющие чаще всего Н2О по месту двойной связи. Альдолаза, гистидаза.
5) Изомеразы - осуществляют взаимопревращения изомеров. Фосфоглицеромутаза.
6) Лигазы (синтетазы) - осуществляют реакции присоединения друг к другу двух молекул с образованием ковалентной связи, в качестве источника энергии используется АТФ. Пируваткарбоксилаза, ацетил-КоА-синтетаза.
ВОПРОС № 38
Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра.
Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
· абсолютную субстратную специфичность;
· групповую субстратную специфичность;
· стереоспецифичность.
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало. Другой пример фермента с абсолютной субстратной специфичностью - уреаза, катализирующая гидролиз мочевины до диоксида углерода и аммиака.
Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов.
Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот.
При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам.
