Координационные соединения в окислительно-восстановительных реакциях
Окислительно-восстановительные свойства координационных соединений определяются электронной конфигурацией комплексообразователя, то есть заселенностью его de - и dg- орбиталей, что в свою очередь зависит от силы лигандов.
Если в результате потери или приобретения электронов образуется ион комплексообразователя с более симметричным распределением электронов, с большими ∆ и ЭСКП, то такое соединение участвует в окислительно-восстановительных реакциях при наличии, естественно, окислителя или восстановителя, в качестве сореагента.
Например, для ионов-восстановителей в октаэдрическом поле легко осуществляются следующие переходы:
[Cr(H2O)6]2+ + O2 +4H+ ® [Cr(H2O)6]3+ + 2H2O.
ВС dε3dγ1 - ē ® ВС dε3dγ0
[Co(NH3)6]2+ + O2 +2H2O ® [Co(NH3)6]3+ +4OH-
ВС dε4dγ3 - ē ® НС dε6dγ0
Очень сильные восстановители и потому неустойчивы низкоспиновые октаэдрические комплексы Co(II):
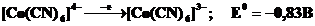
НС dε6dγ1 - ē ® НС dε6dγ0
Октаэдрические комплексные ионы проявляют окислительные свойства, если реализуются, например, такие переходы:
2[Fe(CN)6]3- + H2S® 2[Fe(CN)6]4- + S +2H+
НС dε5dγ0 + 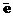 ® НС dε6dγ0
® НС dε6dγ0
[Co(H2O)6]3+ + 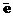 ® [Co(H2O)6]2+, E0=1,84B
® [Co(H2O)6]2+, E0=1,84B
ВС dε4dγ2 + 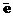 ® ВС dε5dγ2
® ВС dε5dγ2
[Mn(CN)6]3- 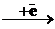 [Mn(CN)6]4-
[Mn(CN)6]4-
НС dε4dγ0 + 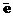 ® НС dε5dγ0
® НС dε5dγ0
Вопросы для самопроверки
1. Определите: а) заряды комплексных ионов, б) заряды и электронные конфигурации комплексообразователей, в) координационные числа и г) тип комплексов в [Cu(NH3)4](OH)2, [Cr(H2O)6]Cl3, H[AuCl4], [Ni(CO)4].
2. Приведите диаграмму расщепления d- орбиталей для октаэдрической симметрии, предскажите образование низко- или высокоспиновой электронной конфигурации на примере комплексов [Co(NO2)6]3-, [CoF6]3-, [Fe(CN)6]3-.
3. Определите энергию стабилизации кристаллическим полем в единицах D для высоко- и низкоспиновых октаэдрических комплексов Fe(III), Co(III).
4. С позиций ТКП объясните, почему гексааквакомплексы Cr(II) и Fe(II) легко окисляются.
5. Вычислите DG0 комплексообразования [Ni(en)3]2+ по реакции
[Ni(NH3)6]3+ +3en = [Ni(en)3]2+ + 6NH3, если b = 1010.
6. Какие изомеры возможны для [CoCl2(en)2]+?
7. Каким должно быть геометрическое строение комплексного катиона CoCl2×6H2O?
8. Ионы Sc3+, Cr3+ и Zn2+ находятся в октаэдрическом окружении лигандов. Какой из этих комплексов окрашен и почему?
9. Чем объясняется диамагнетизм комплексного иона [Pt(NH3)6]4+?
10. Почему октаэдрические комплексы Cr(III) всегда парамагнитны?
Экспериментальная часть
1. Растворение осадка с образованием комплексного соединения
В две пробирки налейте по 3 капли 0,01н раствора азотнокислого серебра AgNO3 и по 2 капли 10% раствора иодистого калия KI. К выпавшим осадкам в одну пробирку добавьте 5 капель 10%-ного раствора тиосульфата натрия (Na2S2O3), а в другую – 5 капель концентрированного раствора аммиака. Что наблюдается?
Напишите уравнение реакции образования тиосульфатного комплекса Na3[Ag(S2O3)2]. Сравните константы образования аммиачного и тиосульфатного комплексов серебра и объясните, почему иодид серебра плохо растворяется в аммиаке и энергично растворяется в тиосульфате натрия.
Напишите выражение для полной константы образования тиосульфатного комплекса. Какую функцию эта реакция выполняет в “серебряной” фотографии?
2. Взаимодействие медно-аммиачного комплекса с целлюлозой
Поместите в пробирку небольшой кусочек ваты и добавьте 3 мл свежеприготовленного медноаммиачного комплекса (реактива Швейцера), полученного растворением Cu(OH)2×CuCO3 в концентрированном водном аммиаке. При размешивании стеклянной палочкой вата постепенно растворяется, образуя вязкую жидкость. Не следует брать большой кусочек ваты, так как это удлиняет продолжительность растворения.


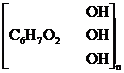 + n[Cu(NH3)m](OH)2 ®
+ n[Cu(NH3)m](OH)2 ®
целлюлоза медно-аммиачный комплекс
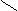
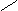 О
О
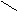 ® [C6H7O2 –– O –– Cu(NH3)z(OH)2]n + (m–z)NH3
® [C6H7O2 –– O –– Cu(NH3)z(OH)2]n + (m–z)NH3
OH
Около одного мл прозрачного густого раствора целлюлозы отлейте в другую пробирку, добавьте в нее 4–5 мл воды и вылейте смесь в стаканчик с 10–12 мл 10% соляной кислоты. Смесь сразу почти совсем обесцвечивается и выделяется свободная целлюлоза в виде белого студенистого осадка.
Объясните изменение окраски раствора при этом.
3. Комплексные соединения в окислительно-восстановительных реакциях
а) В две пробирки налейте по 3 капли раствора сульфата меди CuSO4. В одну добавьте несколько капель концентрированного раствора аммиака до образования сульфата тетраамминмеди (II) с константой устойчивости b=1012. В обе пробирки добавьте по 2 капли иодистого калия, прилейте 5–6 капель хлороформа 1) , закройте пробкой и энергично встряхните. Что наблюдается? Почему в одном случае реакция Cu2+ + 2I- ® CuI + 1/2 I2 возможна, а в другом нет?
б) К 3 каплям 1М раствора CoCl2 добавьте две капли раствора уксусной кислоты (50%), 14–15 капель 2н NaNO2 и через две–три минуты прилейте 5–6 капель насыщенного раствора KCl для осаждения труднорастворимой соли K3[Co(NO2)6].
Реакция протекает по уравнению
[Co(H2O)6]Cl2+7NaNO2+2CH3COOH+3KCl®
K3[Co(NO2)6] +5NaCl+2CH3COONa+7H2O+NO.
Какие функции выполняют Co2+ и NO2- в этой реакции?
Объясните вероятность этой реакции с позиций ТКП (схема расщеплённых d-орбиталей), подтвердите вывод расчетом ЭСКП, если известно, что [Co(H2O)6]2+ - BC, а [Co(NO2)6]3- - НС комплексы.
4. Влияние поля лигандов на окраску комплексов
В три пробирки налейте по 3–4 капли раствора хлорида гексааквакобальта(II) [Co(H2O)6]Cl2 и добавьте по 10 капель: в первую – воды, в остальные – насыщенных растворов ацетата натрия CH3COONa и роданистого аммония NH4NCS. Отметьте изменение окраски. Напишите уравнения реакций, принимая во внимание, что ацетатный комплекс имеет октаэдрическое, а роданидный – тетраэдрическое строение, и в обоих случаях образуются анионные комплексы:
Na4[Co(CH3COO)6] и (NH4)2[Co(NCS)4].
Изменение окраски комплексов объясните в рамках ТКП.
5. Гидратная изомерия
В две конические колбы налейте по 20 мл 1%-ного раствора соли CrCl3×6H2O, состав которой отвечает двухионному комплексному соединению [CrCl2(H2O)4]Cl×2H2O. Одну колбу закройте часовым стеклом и кипятите в течение 7–8 минут. Охладите раствор и перелейте его в мерный цилиндр, добавьте дистиллированной воды до первоначального объема. Обратите внимание на изменение окраски. Измерьте электропроводность первоначального и полученного растворов.
Исходя из величин электропроводности, напишите формулу образовавшегося гидратного изомера (см. раздел “Изомерия комплексных соединений”).
6. Спектрофотометрическое определение состава комплексного соединения и его первой константы образования (b)
Для комплексов с небольшими значениями b экспериментально, с достаточной степенью точности, можно определить первую константу образования (b1).
Изучим реакцию:
[Fe(H2O)6]3+ + NCS- ® [FeNCS(H2O)5]2+ + H2O,
в которой образуется окрашенный комплексный ион, и в оптическом спектре его появляется полоса поглощения при 720 нм.
Если для серии изомолярных растворов построить диаграмму: состав – оптическая плотность D(C), то
─ наличие максимума указывает на образование соединения;
─ наличие размытого максимума свидетельствует о заметной диссоциации комплекса.
Степень диссоциации комплекса (a) равна
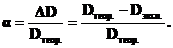 (1)
(1)
Для краткости процесс образования комплекса (I ступень) опишем уравнением
Fe3+ + NCS- = [Fe(NCS)]2+
и обозначим индексом [ ] – равновесные концентрации реагентов, а индексом [ ]0 – их исходные концентрации. Тогда при равенстве исходных концентраций Fe3+ и NCS-равновесные концентрации реагирующих веществ будут равны соответственно
[Fe3+] = [Fe3+]0 ×a, [NCS-] = [NCS-]0 ×a,
[Fe(NCS)2+] = [Fe3+]0 × (1– a) = [NCS-]0 × (1– a),
а для константы образования комплексного иона в этих условиях ([Fe3+]0=[NCS-]0) получим
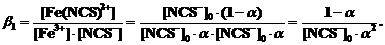 Заметим, что для определения константы образования роданидного комплекса Fe(III) по 1-й ступени соотношение
Заметим, что для определения константы образования роданидного комплекса Fe(III) по 1-й ступени соотношение
концентраций [Fe3+]0:[NCS-]0 должно быть больше (избыток Fe3+) или равно 1, чтобы предотвратить комплексообразование по следующим ступеням: [Fe(NCS)2]+, Fe(NCS)3 и т.д.,
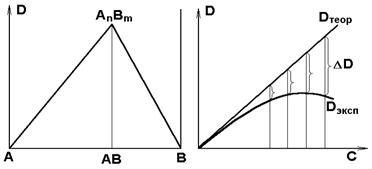
(а) (б)
Рис.9.5. Изменение оптической плотности изомолярных растворов при образовании комплекса
а) зависимость оптической плотности от концентрации комплекса в случае отсутствия диссоциации (Dтеор.)
б) зависимость оптической плотности от концентрации комплекса в случае заметной диссоциации (Dэкспер.)
что может иметь место при избытке роданид-ионов1). В случае избытка Fe3+ его равновесная концентрация будет складываться из избыточной (Dс=[Fe3+]0 –[NCS-]0) концентрации железа, не связанного в комплекс, и железа (III), перешедшего в раствор в результате диссоциации нестойкого комплексного иона [Fe3+] = Dс + [NCS-]0 ×a, и тогда
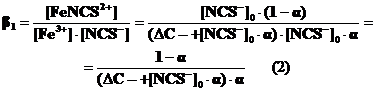
Зная константу образования иона (b1), можно рассчитать DG0 реакции комплексообразования.
DG0 = – RT ln b1.(3)
Работа выполняется в следующем порядке:
1. В 12 колбах приготовьте изомолярные смеси с различным соотношением [Fe3+]0 : [NCS-]0 в соответствии с таблицей 9.4.
2. Проведите измерение оптической плотности растворов (светофильтр № 6), используя в качестве раствора сравнения 0,005М раствор Fe(NO3)3.
3. Постройте график зависимости оптической плотности от состава раствора.
4.Проведите касательную к экспериментальной кривой через точки, соответствующие оптической плотности растворов в колбах №1 (0,005М раствор Fe(NO3)3) и №2 1) . Касательная к экспериментальной кривой определяет зависимость D(с) комплекса в отсутствии диссоциации.
5.Из графика для растворов с [Fe3+] ³ [NCS-]0 (колбы 5,6,7,8) определите DD=Dтеор.– Dэксп., рассчитайте:
а) a по формуле 1
б) b1 по формуле 2
в) DG0 по формуле 3 .
6. Сделайте вывод о влиянии концентрации на степень диссоциации и на константу образования комплексного иона.
7. Объясните сдвиг максимума кривой D(с) в область [NCS-]0 > [Fe3+]0.
Таблица 9.4
| № колбы | мл, р-ра Fe(NO3)3 0,005M | мл, р-ра KNCS 0,005M | конц. моль×л–1 [Fe3+]×103 | конц. моль×л–1 [NCS]×103 | Cоотнош. числа молей | Оптическая плотность |
| 5,0 | 0,0 | 20:0 | ||||
| 4,75 | 0,25 | 19:1 | ||||
| 4,25 | 0,75 | 17:3 | ||||
| 4,0 | 1,0 | 16:4 | ||||
| 3,75 | 1,25 | 15:5 | ||||
| 3,5 | 1,5 | 14:6 | ||||
| 3,0 | 2,0 | 12:8 | ||||
| 2,5 | 2,5 | 10:10 | ||||
| 2,0 | 3,0 | 8:12 | ||||
| 1,5 | 3,5 | 6:14 | ||||
| 1,0 | 4,0 | 4:16 | ||||
| 0,5 | 4,5 | 2:18 | ||||
РАБОТА 10. s- и p- ЭЛЕМЕНТЫ
Водород
Водород, кроме наиболее стабильных молекул Н2 и сольватированного иона Н+, существует в атомарном состоянии, в виде гидрид-иона Н–, молекулярных ионов Н2+ и Н2– . Из-за малого радиуса атома энергия связи в молекуле водорода наибольшая из всех двухатомных гoмoнуклеарных молекул VIIА и IА подгрупп:
| Н2 | F2 | Cl2 | Br2 | I2 | Li2 | Na2 | K2 | |
| Ecв., кДж·моль–1 | 76,5 | 53,0 |
Образование иона Н+ сопровождается резким уменьшением эффективного радиуса, изменением кислотно-основных свойств и окислительно-восстановительных потенциалов некоторых соединений, гидратированием в водных растворах протона с образованием иона гидроксония Н3О+. Наличие вакантной s- орбитали способствует образованию водородной связи.
Водород следует рассматривать как не имеющий полных аналогов химический элемент. Его помещают либо в первую, либо в седьмую группу. К группе галогенов водород можно отнести из-за легкой замещаемости водорода галогенами в органических соединениях и способности к образованию аниона Н– (псевдогалогенид-иона). Сходство спектра водорода со спектрами щелочных элементов, способность взаимодействовать с неметаллами, образование Н+ в растворах, то есть восстановительная активность, позволяет помещать его в IА подгруппу.
Cоединения водорода
Соединения водорода c менее электроотрицательными элементами называют гидридами. Промежуточное значение ОЭО (2,1) позволяет водороду образовывать химические соединения с различной степенью полярности химической связи. По этому признаку различают: ионные (солеобразные) соединения (с s- элементами), ковалентно-полярные (с р- элементами), металлоподобные фазы внедрения с переходными металлами) (табл.10.1).
Переход от одного типа соединений к другому совершается постепенно. Так, гидриды меди и цинка занимают промежуточное положение между ионными и ковалентными, а гидриды серебра и золота сходны с гидридами переходных металлов.
10.2. s- Элементы
Элементы, у которых заполняются внешние s- оболочки, относят к IА (ns1 - Li, Na, K, Rb, Cs, Fr) и IIА (ns2 - Be, Mg, Ca, Sr, Ba, Ra) подгруппам. Степени окисления ns1- и ns2- элементов всегда равны номеру группы.
В основном состоянии атомы s2 - элементов не имеют неспаренных электронов, поэтому образованию ковалентной связи в соединениях этих элементов предшествует возбуждение атомов
Евозб.
Э (ns2) ––––––→ Э* (ns1 nр1).
Эти две валентные sр - гибридные орбитали определяют линейное строение трехатомных молекул ЭХ2 (Х = Н, F, Cl, Br, I).
Для s1 - элементов характерно образование молекул Э2(s)2, для s2 - элементов двухатомные молекулы не обнаружены – из-за равной заселенности связывающих и разрыхляющих орбиталей (s)2 (s*)2 .
При одинаковом строении внешнего уровня атомов в подгруппе возрастающее влияние заряда ядра на валентные электроны частично компенсируется увеличением эффективных радиусов, приводя к снижению энергии ионизации атомов в группах сверху вниз и возрастанию ионности связи в однотипных соединениях. Вследствие небольшого радиуса
Таблица 10.1
Классификация соединений водорода
(численный индекс – относительная электроотрицательность ОЭО)
| I A | II A | IIIB | IV B | V B | VI B | VII В | VIIIB | I B | II B | III A | IV A | V A | VI A | VII A | ||||
| H2,1 | ||||||||||||||||||
| Li1,0 | Be1,5 | B2,0 | C2,5 | N3,0 | O3,5 | F4,0 | ||||||||||||
| Na0,9 | Mg1,2 | Al1,5 | Si1,8 | P2,1 | S2,5 | Cl3,0 | ||||||||||||
| K0,8 | Ca1,0 | Sc1,3 | Ti1,5 | V1,6 | Cr1,6 | Mn1,5 | Fe1,8 | Co1,9 | Ni1,9 | Cu1,9 | Zn1,5 | Ga1,6 | Ge1,8 | As2,0 | Se2,4 | Br2,8 | ||
| Rb0,8 | Sr1,0 | Y1,2 | Zr1,4 | Nb1,6 | Mo1,8 | Tc1,9 | Ru2,2 | Rh2,2 | Pd2,2 | Ag1,9 | Cd1,7 | In1,7 | Sn1,8 | Sb1,9 | Te2,1 | I2,5 | ||
| Cs0,7 | Ba0,9 | La1,1 | Hf1,3 | Ta1,5 | W1,7 | Re1,9 | Os2,2 | Ir2,2 | Pt2,2 | Au2,4 | Hg1,9 | Tl1,8 | Pb1,8 | Bi1,9 | Po2,0 | At2,2 | ||
| Fr0,7 | Ra0,9 | Ac1,1 | ||||||||||||||||
| Ионные соединения | Металлоподобные соединения переменного состава | Промежуточные соединения | Ковалентно-полярные соединения | |||||||||||||||
и высокого значения энергии ионизации бериллий, как правило, не образует соединений с ионной связью.
Соединениям бериллия даже с наиболее электроотрицательными элементами (ВеО, BeF2) свойственен преимущественно ковалентный тип связи.
Величины стандартных окислительно-восстановительных потенциалов s- элементов указывают на их ярко выраженные восстановительные свойства. Все s- элементы вытесняют водород из кислот и воды:
Na + H2O = NaOH + ½H2
K + HCl = KCl + ½ H2
Ba + 2 H2O = Ba(OH)2 + H2,
восстанавливают металлы и неметаллы из оксидов и солей:
2Mg + SnО2 = 2MgO + Sn
2Mg + CО2 = 2MgO + C
Ca + РbCl2 = CaCl2 + Рb.
Химические соединения
Водородные соединенияs- элементов МН и МН2 называют солеподобными гидридами из-за их сходства с галогенидами. Они характеризуются ионным строением кристаллической решетки и высокими температурами плавления. Расплавы этих соединений – электролиты; при их электролизе водород выделяется на аноде (2Н – – 2ē ® Н2). При взаимодействии с водой реакция протекает по окислительно-восстановительному механизму практически необратимо:
LiH + Н2 O ® LiOH + Н2
Н– – ē ® 1/2 Н2
Н2O + ē® 1/2 Н2 + OН–
Отрицательный стандартный электродный потенциал системы ЕоH2/2Н– = –2,23 В указывает на большую склонность
гидрид-иона отдавать электрон, что делает гидриды хорошими восстановителями.
Таблица 10.2.
Энергии ионизации, Е0 и радиусы s- элементов
| Элементы, ns1 | Энергия ионизации, I, эВ | Окислительно-восстановительный потенциал, Ео, В | Металлический радиус, нм |
| Li | 5,39 | –3,02 | 0,155 |
| Na | 5,14 | –2,71 | 0,189 |
| K | 4,34 | –2,93 | 0,236 |
| Rb | 4,18 | –2,99 | 0,248 |
| Cs | 3,89 | –3,02 | 0,268 |
| Элементы, ns2 | Энергия ионизации, I, эВ | Окислительно-восстановительный потенциал, Ео, В | Металлический радиус, нм |
| Be | 9,32 | –1,85 | 0,104 |
| Mg | 7,65 | –2,37 | 0,128 |
| Ca | 6,11 | –2,86 | 0,169 |
| Sr | 5,69 | –2,89 | 0,184 |
| Ba | 5,21 | –2,90 | 0,206 |
| Ra | 5,28 | –2,92 | 0,235 |
Все солеобразные гидриды обладают высокой реакционной способностью:
3ВаН2 + N2 = Ba3N2 + 3Н2
LiH + Cl2 = LiCl + HCl
NaH + CO2 = HCOONa
Гидриды бериллия и магния имеют переходный характер между ионными и ковалентными и в твердом состоянии имеют полимерное строение.
При сжигании в атмосфере кислорода щелочных металлов образуются пероксиды М2O2 (молекулярный ион О22-). Только литий при обычных условиях сгорает в кислороде до
Li2O. Начиная с калия, наряду с М2O2 , образуются надперок-
сиды КO2, RbO2, CsO2 (молекулярные ионы О2-).
Щелочноземельные элементы при взаимодействии с кислородом в аналогичных условиях дают оксиды. Пероксиды получаются труднее, чем для щелочных элементов. Оксиды s - элементов имеют основный характер, что подтверждается характером их взаимодействия с кислотными оксидами:
СO2 + Li2О = Li2СO3.
Исключение составляет ВеО – он амфотерен:
ВеО + Na2О = Na2ВеO2
ВеО + SO3 = BeSO4
Пероксиды проявляют окислительно-восстановительную двойственность за счет пероксид-иона O22–:
O22– + 2ē = 2O2–, O22– – 2ē = O2.
Окислительные свойства пероксидов выражены сильнее, чем восстановительные. Пероксиды и надпероксиды, как сильные окислители, легко разлагаются разбавленными кислотами и водой:
К2О2 + Н2О = КОН + Н2О2
4КO2 + 2H2S O4 = 2H2O + 3O2 + 2 K2SO4
Pеакция 2Na2O2 + 2CO2 = 2Na2CO3 + O2
используется для получения кислорода в подводных лодках и космических кораблях.
Гидроксиды s- элементов получают при взаимодействии оксидов с водой. Большой ионный радиус s- элементов (табл.10.2) делает их гидроксиды сильными основаниями, а увеличение радиуса в группе сверху вниз приводит к усилению основного характера гидроксидов в рядах от Li к Cs и от Ве к Ва.
10.3. р- Элементы
р- Элементы имеют общую конфигурацию ns2 np1–6 и образуют IIIA, IVA, VA, VIA, VIIA, VIIIA подгруппы ПС.
В отличие от s- , р- элементы поливалентны (табл.10.3).
Таблица 10.3
Характерные степени окисления р – элементов
| Подгруппа | IIIA | IVA | VA | VIA | VIIA | VIIIA |
| Валентные электроны | s2p1 | s2p2 | s2p3 | s2p4 | s2p5 | s2p6 |
| Элемент | B | C | N | O | F | Ne |
| Степени окисления | 4, 2 –4 | 3, 5 –3 | –2, –1 | – –1 | ||
| Элемент | Al | Si | P | S | Cl | Ar |
| Степени окисления | 4, (2) –4 | 5, 3 –3 | 6, 4, (2) –2 | 1, 3, 5, 7 –1 | ||
| Элемент | Ga | Ge | As | Se | Br | Kr |
| Степени окисления | 4, 2 | 5, 3 –3 | 6, 4 –2 | 1, 3, 5, 7 –1 | 2, 4, 6 | |
| Элемент | In | Sn | Sb | Te | I | Xe |
| Степени окисления | 3 (1) | 4, 2 | 5, 3 (-3) | 6, (4) | 1, 3, 5, 7 –1 | 2, 4, 6, 8 |
| Элемент | Tl | Pb | Bi | Po | At | Rn |
| Степени окисления | 1, (3) | 2, (4) | 3, (5) | 4, 6, 2 | 5, 7 –1 | 2, 4, 6, 8 |
| Гидроксиды | H3ЭО3 сл.к. НЭО2 сл.к. ЭОН сл.осн. Э(ОН)3осн. | H2ЭО3 сл.к. Н4ЭО4 сл.к. Э(ОН)2осн. | HЭО3 с.к. НЭО2 сл.к. Н3ЭО4 сл.к. Н3ЭО3 сл.к. Э(ОН)3сл.осн. | H2ЭО4 с.к. Н2ЭО3 сл.к. Э(ОН)2сл.осн. | HЭО4 с.к. НЭО3 с.к. НЭО2 сл.к. НЭО оч.сл.к. | H2XеO4 с.к. Н6ХеО6 сл.к. |
с.к. – сильная кислота; сл.к. – слабая кислота; оч.сл. к.– очень слабая кислота;
осн. – основание; ; сл.осн. – слабое основание;
Низшие степени окисления проявляются за счет неспаренных р- электронов, высшие, равные номеру группы – за счет s- и р- электронов. По мере перехода сверху вниз в группах возрастает разница энергии s- и р- подуровней. Поэтому для элементов, стоящих вверху группы, устойчивы высшие степени окисления, внизу – низшие. Например, в IVA подгруппе стабильность соединений со степенью окисления +4 уменьшается в последовательности Ge – Sn – Pb . В той же последовательности увеличивается устойчивость соединений со степенью окисления +2. Изменение устойчивости соединений элементов высших степеней окисления подтверждается, в частности, значениями стандартных электродных потенциалов (ESn4+/Sn2+=0,15В, EoPb4+/Pb2+=1,80B) и температурами разложения водородных соединений:
| Соединение | CH4 | SiH4 | GeH4 | SnH4 | PbH4 |
| tразл., 0С |
