Властивості сульфатної кислоти
Крім властивостей кислоти, концентрована сульфатна кислота виявляє властивості окисника
H2SO4 + Fe = FeSO4 + H2↑
H2SO4 + CuO = CuSO4 + H2O
H2SO4(конц.) + 2NaCl = Na2SO4 + 2HCl
2H2SO4(конц.) + S = 3SO2↑ + 2H2O
Якісна реакція на сульфат-іон 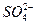 :
:
H2SO4 + BaCl2 = BaSO4↓+2HCl
Білий осад
Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl
Білий осад
|
 |

гідросульфати NaHSO4, Ca(HSO4)2
Реактиви і обладнання: Розбавлена сульфатна кислота, сульфат натрію, хлорид барію, штатив з пробірками.
Хід роботи:
Дослід 1. Налийте в пробірку 1 мл розведеної сульфатної кислотита добавте декілька гранул Цинку.
Завдання та запитання: Що спостерігаєте? Чому? Яка сіль утворилася в результаті реакції?
Дослід 2. Налийте в одну пробірку 1мл сульфатної кислоти, а в другу 1мл натрій сульфату. Добавте в обидві пробірки по декілька крапель барій хлориду.
Завдання та запитання: Запишіть свої спостереження, рівняння реакцій в молекулярному і іонному вигляді.
Запитання до захисту лабораторної роботи:
1.Сульфатна кислота та її солі.
2.Якісна реакція на сульфат-іон.
. Техніка безпеки
- Фізіологічна дія реактивів, що використовуються:
· Сульфатна кислота викликає опіки на шкірі.
· Хлорид барію – отруйний.
- Міри безпеки:.
· Не допускати попадання кислоти на руки, чи одежу.
- Правила першої допомоги:
· Уражене місце кислотою промити великою кількістю води, або 2% розчином соди.
· При необхідності звертатися до лікаря.
·
\
Лабораторна робота № 2
Тема: Добування амоніаку. Вивчення його властивостей. Солі амонію.
Мета: Ознайомитись з добуванням амоніаку. Вивчити його властивості. Провести реакції з солями амонію.
Теоретичні відомості
Амоніак NH3 -безбарвний газ, різким запахом, набагато легший за повітря, дуже добре розчиняється у воді (за 20°C в 1 об‘ємі води – 700 об‘ємів NH3), за температури, нижчій за -33,4°C переходить у рідкий стан. Дуже уражує слизові оболонки очей і дихальних шляхів.
1. Окиснення амоніаку.Амоніак маючи низький ступінь окиснення Нітрогену -3, поводить себе як відновник.
4NH3 + 3O2 = 2N2↑ + 6H2O
4HN3 + 5O2 = 4NO↑ + 6H2O
2. Взаємодія з водою.Амоніак добре розчиняється у воді, утворюючи амоніачну воду.
NH3 + H2O = NH3 * H2O = NH4+ +OH-
Добування.У лабораторії амоніак добувають із суміші твердих речовин – нашатирю NH4Cl і гашеного вапна Ca(OH)2 за рівнянням:
2 NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
Застосування:Амоніак застосовується як мінеральне добриво та для виробництва вибухових речовин.
СОЛІ АМОНІЮ
Солі амонію – це кристалічні речовини з йонним типом зв’язку. До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку.
Якщо змочити одну скляну паличку концентрованим розчином амоніаку, а іншу – концентрованою хлоридною кислотою і піднести їх одну до одної, то з‘являється білий дим – дрібні кристалики хлориду амонію (нашатирю):
NH3 + HCl = NH4Cl
Властивості оксиду нітрогену (ІІ)
Нітроген (ІІ) NO оксид – це безбарвний газ, який при -151,8°C зріджується, а при -163,7°C твердне. За хімічними властивостями він належить до несолетворних оксидів і для нього характерні реакції приєднання 2NO + O2 = 2NO2↑
