Перманаганатометричним методом
Використовуючи реакцію оксидації-відновлення, що протікає між K2Cr2O7 і йонами Fe2+ можна з успіхом визначити сам калію дихромат з великою точністю, застосовуючи перманганатометричний метод зворотнього титрування надлишку йонів Fe2+ стандартним розчином KMnO4.
Перманганатометричне визначення дихромату за допомогою сполуки феруму (ІІ) основане на методі обробки наважки або аліквотної частини досліджуваного розчину надлишком йонів Fe2+. При цьому еквівалентна вмісту оксидника (Сr6+) частина відновника (Fe2+) оксидується, а надлишкова кількість відновника, що не ввійшла в реакцію з оксидником, відтитровується стандартним розчином іншого допоміжного оксидника (Mn7+).
Знаючи, яка кількість стандартного розчину оксидника була витрачена на титрування надлишку взятого відновника, легко обчислити масу оксидника (Сr6+), який визначається.
Хід аналізу
Визначення дихромату може бути проведене методом піпетування або окремих наважок. Для цього обчислені наважки калію дихромату переносять у пронумеровані конічні колби, розчиняють у 100 см3 2н розчину сульфатної кислоти і додають по 10 см3 концентрованої ортофосфатної кислоти. Вміст колб перемішують, охолоджують до кімнатної температури, додають по 25 см3 вихідного розчину солі Мора і знову перемішують. Потім надлишок солі Мора відтитровують стандартним розчином калію перманганату до зміни зеленого кольору до червоно-фіолетового або синьо-фіолетового (в залежності від розміру взятої наважки дихромату). Паралельно проводять контрольний дослід титруванням 25 см3 розчину солі Мора в тих же умовах.
На зворотнє титрування надлишку солі Мора повинно витрачатися біля половини за об’ємом стандартного розчину калію перманганату, який пішов на титрування контрольного досліду. Якщо об’єм витраченого стандартного розчину перманганату сильно відрізняється від цього, то беруть більшу або меншу наважку дихромату.
У випадку визначення дихромату методом піпетування обраховують наважку в десять раз більшу в порівнянні з наважками, що були при титруванні за методом окремих наважок. Обчислену наважку дихромату розчиняють у мірній колбі місткістю 250 см3 в дистильованій воді, додають 60 см3 2н розчину сульфатної кислоти і 20 см3 концентрованої ортофосфатної кислоти. Вміст колби перемішують, охолоджують до кімнатної температури, доводять розчин водою до мітки, обережно (дотримуючись техніки безпеки) відбирають аліквотні частини отриманого розчину в конічну колбу для титрування, в яку додають 25 см3 вихідної солі Мора, розбавляють 100 см3 дистильованої води і титрують надлишок солі Мора стандартним розчином калію перманганату, як вказано вище.
Завдання 5. Визначення феруму в розчині солі Мора
Сіль Мора має склад (NH4)2SO4•FeSO4•6H2O. При титруванні калію перманганатом розчину цієї солі в кислому середовищі протікає реакція:
2KMnO4 + 10(NH4)2Fe(SO4)2 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4
+ 10(NH4)2SO4 + 8H2O.
Молярна маса еквіваленту феруму в цій реакції дорівнює 55,85 г/моль.
Отриманий в мірній колбі розчин (з невідомим вмістом заліза) доводять до мітки дистильованою водою і добре перемішують. Відбирають піпеткою 20 см3 (25 см3) цього розчину, переносять у конічну колбу, додають 20 см3 (25 см3) 1М розчину сульфатної кислоти і титрують робочим розчином калію перманганату до появи блідо-рожевого забарвлення, яке не зникає протягом 30 секунд. Проводять не менше трьох титрувань (для отримання результатів, що відрізняються не більше, чим на 0,1 см3), розраховують середнє значення об’єму розчину KMnO4, що пішов на титрування.
Концентрацію розчину солі Мора обраховують за формулою:
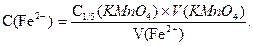
Вміст феруму в розчині солі Мора розраховують за формулою:
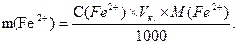
Завдання 6. Визначення процентного складу гідрогену
пероксиду в розчині
Гідрогену пероксид (пергідроль) містить біля 30 % Н2О2. Вміст препарату визначають масовою часткою вмісту Н2О2. З часом гідрогену пероксид розкладається з виділенням кисню, тому для перевірки якості препарату визначають процентний вміст Н2О2.
Перманганатометричне визначення гідрогену пероксиду основане на реакції оксидації його до вільного кисню:
2KMnO4 + 5Н2О2 + 3Н2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5О2.
У цій реакції гідрогену пероксид виявляє властивості відновника, віддаючи два електрони:
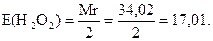
Наважку гідрогену пероксиду беруть з таким розрахунком, щоб отримати 100 см3 приблизно 0,1н розчину:
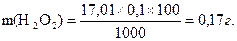
Наважку пергідролю, яку слід взяти для аналізу, розраховують із співвідношення:
30 г Н2О2 міститься в 100 г 30%-го розчину Н2О2
0,17 г Н2О2 міститься в х г 30%-го розчину Н2О2.
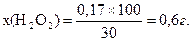
Наважку зважують на аналітичних терезах. Спочатку зважують пустий бюкс, потім наливають у нього 0,5-0,6 г розчину пергідролю і знову зважують. За різницею мас обраховують величину наважки. Після цього в бюкс вливають 15-20 см3 води, розчин кількісно переносять у мірну колбу ємністю 100 см3, доводять водою до мітки і вміст колби перемішують.
Відібравши піпеткою певний об’єм приготованого розчину в конічну колбу, додають до розчину рівний об’єм 2н розчину сульфатної кислоти. Потім вміст колби титрують 0,1н розчином калію перманганату до появи блідо-рожевого забарвлення, яке не зникає на протязі 30 секунд. Титрування повторюють ще 2-3 рази і беруть середнє значення з близьких результатів.
Якщо аналізується 3%-й розчин гідрогену пероксиду, то для аналізу відмірюють піпеткою 10 см3 досліджуваного розчину. Оскільки густина розведеного розчину гідрогену пероксиду практично рівна одиниці, то в даному випадку 10 см3 його мають масу 10 г.
Відібравши піпеткою 10 см3 приготованого розчину в конічну колбу, додають до розчину 5 см3 приготованого 2н розчину сульфатної кислоти. Потім вміст колби титрують 0,1н розчином калію перманганату до появи блідо-рожевого забарвлення, що не зникає протягом 30 секунд. Титрування повторюють ще 2-3 рази і беруть середнє значення з близьких результатів.
Приклад. Із 3,2 см3 гідрогену пероксиду, взятих для аналізу, приготували 250 см3 розчину. На титрування 25 см3 цього розчину пішло 6,4 см3 0,1н розчину калію перманганату. Визначити процентний вміст Н2О2 в розчині.
Обраховують нормальність приготованого розчину гідрогену пероксиду:
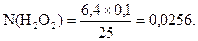
Кількість Н2О2 в 250 см3 розчину, а отже, і у взятій наважці дорівнює:
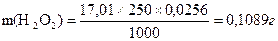
або в процентах:
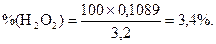
ЛІТЕРАТУРA
1.Аналітична хімія: Навчальний посібник/ О.М.Гайдукевич, В.В.Болотов, Ю.В.Сич та ін. –Х.: Основа, Видавництво НФАУ, 2000. –432 с.
2.Пономарев В.Д. Аналитическая химия: В двух ч. –М.: Высшая школа, 1982. –Ч.1. –304 с; Ч.2. –303 с.
3.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
4.Харитонов Ю.Я. Аналитическая химия. В 2-х кн.. Кн. 1. Общие теоретические основы. Качественный анализ. М.: Высшая школа, 2001. –604 с.
5.Харитонов Ю.Я. Аналитическая химия. В 2-х кн.. Кн. 1. Количественный анализ. Физико-химические методы анализа -М.: Высшая школа, 2001. –645 с.
6.Конспект лекцій.
7.Основы аналитической химии: В 2-х кн. Учеб. для вузов/ Ю.А.Золотов, Е.Н.Дорохова, В.И.Фадеева и др. –М.: Высшая школа, 1996. –Кн.1. –383 с.; Кн.2. –461 с.
8.Пилипенко А.Т., Пятницкий И.В. Аналитическая химия: В 2-х кн. –М.: Химия, 1990. –Кн.1. –480 с.; Кн.2. –460 с.
9.Лурье Ю.Ю. Справочник по аналитической химии. –М.: Химия, 1989. –447 с.
10.Дорохова Е.Н., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа. –М.: Высшая школа, 1991. –256с.
11.Скуг Д., Уэст Д. Основы аналитической химии: В 2-х кн. –М.: Мир, 1979. –Кн.1. –480 с.; Кн.2. –430 с.
12.Васильев В.П. Аналитическая химия: В 2-х кн. –М.: Высшая школа, 1989. –Кн.1. –319 с.; Кн.2. –383 с.
13.Державна Фармакопея України. –1-е вид. –Харків: РІРЕГ, 2001. –Доповнення 1. -2004. -520 с.
14.Кількісний аналіз. Титриметричні методи аналізу / В.В.Петренко, Л.М.Стрілець, С.О.Васюк – Запоріжжя, 2006. -215 с.
ЗАНЯТТЯ №23
ТЕМА: Оксидаційно-відновне титрування. Йодометрія. Приготування стандартних розчинів, визначення їх концентрації. Визначення відновників, сульфітів, формальдегіду і аскорбінової кислоти. Контрольна задача.
АКТУАЛЬНІСТЬ:Вміння визначати кількісний вміст різних речовин методом йодометрії дає можливість застосовувати отримані навики при вивченні фармацевтичного, фітохімічного та хіміко-токсикологічного аналізу, є необхідними умовами для аналізу речовин і правильного трактування одержаних результатів досліджень.
НАВЧАЛЬНІ ЦІЛІ: Освоєння методики кількісного визначення вмісту різних речовин методом йодометрії за допомогою виготовлених титрантів.
ЗНАТИ: -техніку виконання операцій в кількісному титриметричному аналізі;
-розрахунки процентного вмісту досліджуваної речовини за
результатами аналізу;
-правила титрування в йодометрії;
-вихідні речовини для виготовлення стандартних розчинів;
-розрахунки величини наважки при виготовленні
стандартних розчинів.
ВМІТИ:-проводити розрахунки молярної маси еквіваленту речовини
при виготовленні розчинів;
-встановлювати точку кінця титрування;
-виготовити стандартні розчини;
-проводити титрування речовин методом йодометрії, дотримуючись
умов титрування;
-володіти технікою та методиками прямого та зворотнього
титрування;
-кількісно визначати речовини, які застосовуються у фармації
методом йодометрії;
-робити висновки з результатів аналізу і оформляти їх у
вигляді протоколу.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Які можуть бути помилки в методі йодометричного титрування? Відповідь обґрунтуйте та запишіть.
2.Основи оксидаційно-відновного титрування.
3.В чому суть методу йодометрії? Відповідь обґрунтуйте та запишіть.
4.Хімічні властивості йоду та йодид-йонів, використання їх у кількісному аналізі, основне рівняння методу. Відповідь запишіть.
5.Які оксидники та відновники можна титрувати розчином йоду? Напишіть реакції, які лежать в основі йодиметричного визначення натрію тіосульфату, сульфітів, натрію арсеніту.
6.Що таке пряме титрування, зворотнє титрування (титрування за залишком) та титрування за заміщенням?
7.Чому дорівнює молярна маса еквіваленту натрію тіосульфату при його взаємодії з йодом?
8.Чому титрований розчин йоду готують водний, а не з органічними розчинниками?
9.Умови виготовлення титрованих розчинів натрію тіосульфату та йоду, їх зберігання і стандартизація.
10.Знайти титр, нормальність і титр за йодом розчину, для приготування 1 дм3 якого взяли 5,200 г калію дихромату.
11.Для встановлення титру натрію тіосульфату взяли наважку 0,1125 г міді (х.ч.), розчин якої обробили розчином калію йодиду. Йод, який виділився, відтитрували досліджуваним розчином натрію тіосульфату, якого використали 17,99 см3. Розрахувати: а) титр цього розчину; б) титр розчину натрію тіосульфату по Cu.
12.Яку наважку калію дихромату необхідно взяти для встановлення титру 0,1 моль/дм3 розчину натрію тіосульфату, якщо на приготування розчину первинного стандарту K2Cr2O7 є мірна колба місткістю 250 см3 та піпетка для відбору аліквоти об’ємом 10,00 см3? Рекомендований об’єм тіосульфату, що повинен піти на титрування йоду, який виділиться, становить 25,00 см3.
КОНТРОЛЬНІ ПИТАННЯ
1.Можливості йодометричного методу аналізу.
2.Наведіть приклади йодометричних визначень, напишіть відповідні реакції.
3.Йодометричне визначення сильних оксидників. Відповідь обґрунтуйте та запишіть.
4.Визначення кінцевої точки титрування. Застосування крохмалю, як індикатора, при визначенні відновників, а також при титруванні сильних оксидників.
5.Чи можна передбачити, які речовини у даній реакції будуть оксидниками, а які відновниками, якщо відомі стандартні оксидаційно-відновні потенціали? Відповідь обґрунтуйте та запишіть.
6.Напишіть рівняння Нернста для розрахунку величини оксидаційно-відновного потенціалу.
7.Помилки у методах редоксиметрії.
8.Наведіть і запишіть приклади прямого і зворотнього титрування, а також титрування за заміщенням у редоксиметрії.
9.Вплив температури, концентрації реагуючих речовин та каталізаторів на швидкість оксидаційно-відновних реакцій. Відповідь обґрунтуйте та напишіть у зошиті.
10.Що таке автокаталіз? Наведіть приклади реакцій.
11Криві титрування методів редоксиметрії.
12.Як залежить величина оксидаційно-відновного потенціалу від концентрації оксидника і відновника?
13.Індикатори методів редоксиметрії та їх класифікація. Відповідь обґрунтуйте та напишіть у зошиті.
14.Зворотні та незворотні індикатори. Наведіть приклади їх застосування у методах редоксиметрії.
15.Які вимоги до реакцій, що можуть використовуватися в оксидаційно-відновному титруванні?
16.Використання йодиметрії в аналізі лікарських речовин.
17.Скільки грамів Cl2 міститься в 1 дм3 хлорної води, якщо на титрування йоду, який виділяється з 25 см3 її при дії калію йодиду, використано 20,10 см3 0,1100 моль/дм3 розчину натрію тіосульфату?
18.Для визначення H2S до 25,00 см3 його розчину додали 50,00 см3 0,0098 моль/дм3 розчину йоду, після чого надлишок йоду від титрували 11,00 см3 0,02040 моль/дм3 розчину натрій тіосульфату. Скільки грамів H2S міститься в 1 дм3 досліджуваного розчину?
19.У мірну колбу місткістю 250 см3 перенесли наважку 3,3590 г хлорного вапна і довели водою до мітки. На титрування 25,00 см3 отриманої суспензії після відповідної обробки витратили 18,29 см3 розчину натрію тіосульфату (Т=0,0453 г/см3). Розрахуйте % активного хлору.
20.На титрування 25 см3 розчину натрію тіосульфату з Т(Na2S2O3) = 0,01716 витрачено 26,5 см3 розчину йоду. Визначити концентрацію йоду в 1 дм3.
21.До 30 см3 0,1070н розчину калію перманганату додали сульфатну кислоту і надлишок калію йодиду. На титрування йоду, що виділився, витрачено 33,27 см3 розчину натрію тіосульфату. Визначити нормальність розчину Na2S2O3 і його титр за йодом.
22.Скільки 0,5н розчину натрію тіосульфату необхідно для титрування йоду, що виділився при взаємодії 50 см3 0,2н розчину калію перманганату з надлишком калію йодиду в присутності сульфатної кислоти?
23.У 250 см3 розчину міститься 1,1780 г калію дихромату. На титрування 25 см3 цього розчину необхідно 23,38 см3 розчину натрію тіосульфату. Обчислити нормальність і титр розчину тіосульфату.
24.Скільки г хлороводню міститься в 200,0 см3 розчину хлоридної кислоти, якщо на титрування йоду, який виділився після взаємодії 20,00 см3 кислоти з надлишком суміші калію йодиду і калію йодату, витратили 18,25 см3 0,02М розчину натрію тіосульфату?
25.Визначити масову частку аскорбінової кислоти, якщо на титрування наважки масою 0,3568 г витрачено 19,95 см3 0,1008 моль/дм3 розчину йоду (М(С6Н8О6 = 176,13 г/моль).
САМОСТІЙНА АУДИТОРНА РОБОТА
1.Ознайомитись з методом йодиметрії за допомогою дослідів, описаних в даних методичних вказівках.
2.Виготовляти стандартні розчини методу йодиметрії.
3.Виконати лабораторні роботи, вказані в цих методичних матеріалах.
4.Оформити та захистити протокол.
5.Відповідати на запитання, запропоновані викладачем, з використанням записів на дошці.
6.Розв'язувати розрахункові задач, запропоновані викладачем.
Експериментальна частина
Завдання 1. Приготування розчину натрію тіосульфату
Na2S2O3•5H2O
Приготувати титрований розчин натрію тіосульфату за точною наважкою не можна за наступними причинами:
1.Натрію тіосульфат реагує з карбонатною кислотою, розчиненою у воді:
S2O32- + H2O + CO2 = HSO3- + HCO3- + S↓
Внаслідок цього концентрація тіосульфату в розчині після його приготування протягом деякого часу змінюється. Тому концентрацію встановлюють через 8-10 днів після приготування розчину. Вплив вуглекислого газу можна зменшити, якщо до 1 дм3 розчину натрію тіосульфату додати 0,1 г натрію карбонату, який реагуючи з карбону (IV) оксидом, зв’язує йони карбонатної кислоти.
2.Натрію тіосульфат оксидується киснем повітря:
Na2S2O3 + O2 = Na2SO4 + 2S↓
Внаслідок цього титр необхідно періодично перевіряти.
3.Натрію тіосульфат розкладається тіобактеріями.
Для попередження цього рекомендується додавати в якості антисептика HgI2 (10 мг на 1 дм3 розчину) і зберігати розчини захищеному від світла місці.
Розчин натрію тіосульфату готують приблизної концентрації і встановлюють точну концентрацію за допомогою калію дихромату.
Титр Na2S2O3 встановлюють на основі загального принципу йодиметричного визначення оксидників, тобто спочатку діють на суміш KI і H2SO4 точно виміряним об’ємом титрованого розчину K2Cr2O7:
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O.
Йод відтитровують досліджуваним розчином натрію тіосульфату:
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI.
У відповідності з цими реакціями молярна маса еквіваленту (М) калію дихромату дорівнює 49,03 г/моль, молярна маса еквіваленту (М) натрію тіосульфату дорівнює 248,2 г/моль.
Звідси, маса наважки натрію тіосульфату для приготування 0,02н розчину:
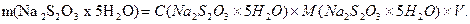
Наважку натрію тіосульфату зважують на технічних терезах, переносять у склянку з темного скла для приготування розчину і добавляють необхідний об’єм свіжопрокип’яченої охолодженої дистильованої води. Розчин перемішують і встановлюють титр через декілька днів.
Завдання 2. Приготування розчину калію дихромату
K2Cr2O7
Цей розчин готують за точною наважкою. Масу наважки калію дихромату розраховують за формулою:
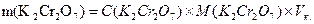
Беруть наважку, зважують на аналітичних терезах, переносять у мірну колбу місткістю 250 см3, розчиняють у дистильованій воді, доводять розчин до мітки і добре перемішують. Наприклад, маса калію дихромату, необхідна для приготування 250 см3 0,02н розчину дорівнює:
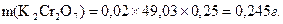
Завдання 3. Встановлення концентрації розчину натрію
тіосульфату за калію дихроматом
У колбу для титрування наливають за допомогою циліндра 5-7 см3 20 %-го (за масою) розчину калію йодиду, 10-15 см3 2М розчину сульфатної кислоти. Додають піпеткою аліквотну частину (25 см3) розчину калію дихромату і, накривши колбу годинниковим склом, щоб попередити втрати від випаровування йоду, для завершення реакції залишають суміш в темноті на 5 хвилин. Потім знімають годинникове скло і омивають його над колбою дистильованою водою. Додають у колбу близько 200 см3 води і приступають до титрування натрію тіосульфатом, налитим в бюретку.
Спочатку титрують без індикатора. Коли забарвлення розчину з темно-бурого перетвориться в блідо-жовте, додають приблизно 5 см3 розчину крохмалю і продовжують титрувати до переходу синього кольору в блідо-зелений від однієї краплі розчину натрію тіосульфату. Останні краплі слід додавати повільно, щоб не перетитрувати розчин. Якщо титрування проведено правильно, то від однієї краплі розчину калію дихромату розчин у колбі повинен забарвитись у синій колір.
Хоча калію дихромат та натрію тіосульфат між собою не взаємодіють, їх кількості, затрачені на реакції, еквівалентні. Тому концентрацію натрію тіосульфату обчислюють за формулою:
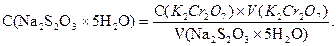
Завдання 4. Приготування вихідного розчину йоду
Розчин йоду може бути приготований за точною наважкою, але для цього йод попередньо очищують від домішок сублімацією. Однак, внаслідок труднощів при такому приготуванні, зв’язаних з леткістю йоду, звичайно розчин йоду готують приблизної концентрації і встановлюють точну концентрацію, титруючи розчином натрію тіосульфату з відомою концентрацією, як описано вище. Концентрацію йоду в розчині обчислюють за формулою:
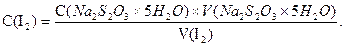
Робочий титрований розчин йоду необхідний при йодиметричному визначенні відновників.
Масу наважки mдля приготування розчину приблизно 0,02н концентрації обраховують за формулою:
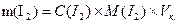
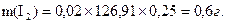
Зважують 0,6-0,7 г йоду на технічних терезах. Одночасно 2-3 г KIрозчиняють в якомога найменшому об’ємі води. В отриманий розчин вносять наважку йоду і після розчинення розбавляють водою до 250 см3. Титр встановлюють за тіосульфатом, який наливають у бюретку. Піпеткою відбирають певний об’єм розчину йоду, переносять у конічну колбу для титрування і титрують розчином натрію тіосульфату, використовуючи як індикатор крохмаль.
