Процесс обжига цементного клинкера
Общие понятия
Для того чтобы получить из сырьевой муки цементный клинкер, материал нагревают до температуры около 1450 °С. При спекании, таким образом, создаются новые, химически активные соединения, которые называются клинкерными фазами. Для процесса обжига клинкера требуется окислительная атмосфера в печи, в противном случае клинкер получается коричневого цвета (вместо черного цвета), снижается прочность цемента и гидратация замедляется. Во время обжига происходит расход тепла на нагрев материала, высушивание, на процессы обезвоживания и разложения глинистых минералов, разложение карбонатов кальция и магния, на химические процессы спекания в результате твердофазных реакций и реакций с участием расплава. Скорость этих процессов и расход тепла в них зависят от химического состава сырьевой шихты, минералогического состава и физических факторов. Полное протекание этих эндотермических реакций является решающим для качества цемента.
В таблице 1.9 приводится обзор реакций, описанных ниже. Рисунок 1.14 показывает ход реакции процессов образования клинкера во время обжига в печи. В литературе содержится подробная информация о процессах клинкерообразования [53,71,72,73,74,75, 76].
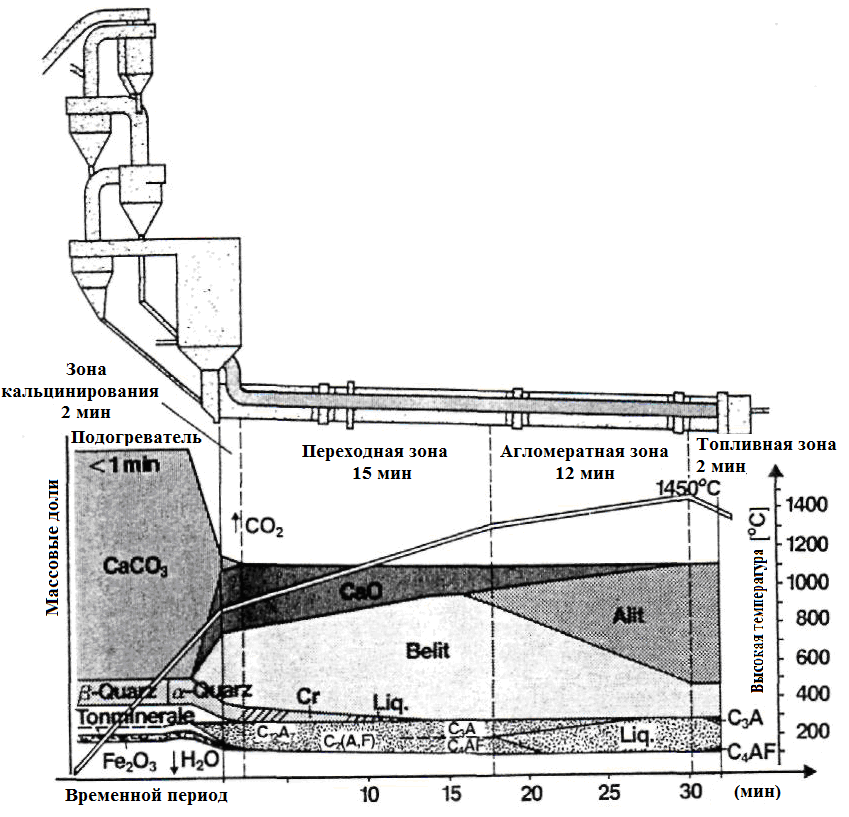
Рисунок 1.14 - Реакции во время технологического процесса обжига портландцементного клинкера (по Вольтеру) [76]
Дегидратация
Глинистые минералы (каолинит, галлуазит, монтмориллонит) в интервале температур 50...100 0С теряют капельно-жидкую физически связанную воду.
Таблица 1.9 - Химические реакции при термической обработке портландцементной сырьевой муки (основные реакции обжига клинкера) по [77]
| Teмпература, °C | Происходящий процесс | Химическая реакция |
| <200 | Удаление свободной воды (сушка) | |
| 100-400 | Удаление адсорбированной воды | |
| 400-750 | Разложение глины. Формирование метакаолинита | Al4[(OH)8 Si4О10] → 2(А12О3·2SiО2) + 4H2О |
| 600-900 | Разложение метакаолинита и др. с образованием высоко реакционной смеси оксидов | А12О3·2SiО2 →Al2О3 + 2SiО2 |
| 600-1000 | Разложение известняка с дальнейшим формированием СS и СА | CaCO3 → CaO + CO2 3CaO + 2SiO2 + А12О3 →2(CaО· SiО2) + CaО·Al2О3 |
| 800-1300 | Твердофазовые реакции с участием CS и СА, формирование C4AF, C3A и C2S | CaO·SiO2 + CaO → 2CaО·SiО2 2CaO + SiО2 →2CaО·SiО2 CaO·A12O3 + 2CaO →3CaO·A12O3 CaO·A12O3 + 3CaO + Fe2О3→4CaO·A12O3 ·Fe2О3 |
| 1250-1450 | Дальнейшее клинкерообразование с синтезом C3S из C2S | 2CaО·SiО2+ CaO→ 3CaО·SiО2 |
Реакции в твердой фазе
В интервале температур от 100 до 400 °С из глинистых минералов удаляется адсорбционная и частично кристаллизационная вода. В пределах температуры 400-700 оС из кристаллических решеток водных алюмосиликатов выделяется кристаллизационная и кристаллохимическая вода, а остальная часть 2...3 % выделяется только при 900...1000 0С.
В качестве примера, дегидратации каолинита была приведена реакция образования метакаолинита:
Al4[(OH)8 Si4О10] → 2(А12О3·2SiО2) + 4H2О Уравнение 9
В интервале температур 600-900 °С метакаолинит и соответствующие продукты реакции, например, распадаются на реактивные смеси оксидов, в соответствии с:
А12О3·2SiО2 →Al2О3 + 2SiО2 Уравнение 10
Обезвоживание глин зависит от типа минералов, вида и количества примесей, размера частиц, типа кристаллической решетки и вида среды атмосферы.
Содержащийся в сырьевой муке CaCO3 разлагается при температурах выше 896 °С, так как парциальное давление CO2 не превышает 1 бар в соответствии с:
CaCO3 → CaO + CO2 Уравнение 11
Реакция энтальпии этого процесса составляет 1660 кДж/кг. Указанная температура действительна только для чистого кальцита; с увеличением количества примесей (например, как и в сырьевой смеси цемента), термическое разложение смещается в сторону низких температур. Она начинается на практике даже при 550-600 °С. Это вызвано химическими реакциями в результате взаимодействия CaO и примесей SiО2, Al2О3 и Fe2О3. Таким образом, содержание свободного СаО (свободная известь) при температурах менее 800 °С является низким и составляет < 2%, только при более высоких температурах содержание свободного СаО будет временно повышаться до приблизительно 20 %.
Термическое расщепление MgCO3 происходит при более низких температурах и для процессов клинкерообразования по существу имеет меньшее значение.
Примерно при температурах 550-600 °C начинаются твердофазовые реакции между СаО, образованной в результате разложения СаСО3, и продуктами разложения глины (SiО2, A12O3) в которых образуются первоначально кальциевые соединения предпочтительно монокальциевый алюминат CA, монокальциевый силикат CS. Формирование трехкальциевого алюмината (С3А), алюмоферрита кальция (С2(A,F) и двухкальциевого силиката (C2S) в портландцементном клинкере начинается при температуре около 800 °С.
CaO·A12O3 + 2CaO →3CaO·A12O3 Уравнение 12
CaO·A12O3 + 3CaO + Fe2О3→4CaO·A12O3·Fe2О3 Уравнение 13
Реакции в твердом состоянии, которые происходят очень медленно, могут быть ускорены за счет уменьшения размера зерна (тонкого помола сырья), повышения температуры и дефектов кристаллической решетки.
Реакции во время спекания
Первый этап плавления и, таким образом, начало спекания происходит при температуре около 1260-1310 °С. Участок плавления в клинкере возрастает с увеличением температуры. При 1450 °С количество расплава составляет около 20 - 30% и зависит от химического состава обжигаемого материала. С увеличением силикатного модуля доля расплава в клинкере уменьшается. Появление капель расплава в сырьевой смеси с высоким уровнем несвязанного CaO является началом процесса спекания клинкера. С образованием расплава СаО и C2S растворяются в нем и реагируют с образованием трехкальциевого силиката в соответствии с реакцией:
CaO + 2CaО·SiО2 → 3CaО·SiО2 Уравнение 14
Диффузия реагентов в расплаве заметно ускоряется. Это главная задача спекания, формирование ценного кристаллического трехкальциевого силиката выполнено. Это оправдывает дорогостоящий процесс обжига клинкера при высокой температуре спекания. Примеси, состоящие из алюмината и феррита расплавленной фазы, встраиваются в кристаллические решетки двухкальциевого и трехкальциевого силикатов в виде твердых фаз и образуют твердые растворы минералов. В расплаве при температурах > 1400 оС растворен весь A12O3 и Fe2О3, в последующем образующий портландцементный клинкер. Расплав имеет примерный состав 56% CaO, 7% SiО2, 23% Al2О3 и 14% Fe2О3. Кроме того, расплав способствует другим реакциям, например, таким как конверсия крупнозернистого кварца или известняка. Эти реакции могут ускоряться (особенно кварц) за счет увеличения зоны плавления, снижения вязкости расплава и деградации (разрушения) крупной фракции.
Вязкость расплава снижается с уменьшением величины глиноземистого модуля или с увеличением содержания Fe2O3. Посторонние включения также влияют на вязкость расплава, увеличение содержания щелочей, CaSО4 и MgO снижают вязкость.
Реакции при охлаждении
Важным процессом получения цементного клинкера является его охлаждение. Из зоны охлаждения вращающихся печей клинкер выходит с температурой 1100…1300 0С. Окончательное охлаждение его осуществляется в холодильниках.
Охлаждение клинкера оказывает существенное влияние на структуру, минералогический состав, размалываемость и, следовательно, на качество полученного из него цемента.
В первую очередь скорость охлаждения клинкера оказывает влияние на соотношение кристаллической и стекловидной фаз. При медленном охлаждении происходит кристаллизация, а при быстром – образование кристаллов замедляется и значительная часть расплава застывает в виде клинкерного стекла. Доля расплава в клинкере вращающихся печей составляет 20…25 %.
Скорость охлаждения клинкера влияет на постоянство изменения объема цемента. При быстром охлаждении большое количество MgO переходит в стекловидную фазу либо остается в микрокристаллическом состоянии (размер зерен до 5…8 мкм). При медленном охлаждении кристаллы MgO увеличиваются в размерах, достигают 30…150 мкм, что вызывает неравномерность изменения объема цемента при твердении. При резком обжиге и быстром охлаждении клинкера образуются небольшие кристаллы алита, что повышает прочность цементного камня.
Процесс охлаждения клинкера обусловливает также химическую стойкость цемента. Быстрое охлаждение клинкера повышает сульфатостойкость цемента. Это объясняется тем, что С3А, определяющий стойкость клинкера по отношению к сульфатной агрессии, при быстром охлаждении в основном переходит в стекловидную форму и становится менее чувствительным по отношению к воздействию сульфатов.
Размалываемость клинкера зависит от многих факторов, в т.ч. и от скорости охлаждения. Сравнение данных по размалываемости быстро и медленно охлажденных клинкеров, свидетельствуют о том, что клинкер охлажденный (медленно) в барабанном холодильнике, требует более высоких энергозатрат на помол, чем клинкер, охлажденный (быстро) в колосниковом холодильнике. Более высокое содержание стекловидной фазы и небольшие размеры кристаллов клинкерных минералов повышают размалываемость быстро охлажденного клинкера по сравнению с охлажденным медленно. Эти данные показывают на необходимость быстрого охлаждения клинкера.
При очень медленном охлаждении клинкер будет разлагаться до двухкальциевого силиката, в результате снижается содержание в клинкере части ценного трехкальциевого силиката. Соответственно, очень медленное охлаждение приводит к снижению прочности цемента [78]. При быстром охлаждении, что желательно, расплав затвердевает в виде клинкерного стекла. В отличие от расплавов, богатых SiО2, которые затвердевают (застывают) обычно застеклованные, в производственном процессе портландцементного клинкера кристаллизуется также алюмоферритная фаза. Таким образом, производственный клинкер, полученный при температуре спекания, представляет собой частично закристаллизованный и частично «замороженный» в виде равновесного расплава материал (застывший в виде клинкерного стекла).
