Тема: Коагуляція колоїдних розчинів. Колоїдний захист
Актуальність теми:Електрокінетичні властивості колоїдних систем обумовлені наявністю в їх частинках подвійного електричного шару. Наявність таких частинок, що несуть певний заряд, обумовлює явище коагуляції, тобто злипання частинок у більші агрегати. Знання причин коагуляції може допомогти при лікуванні хвороб викликаних коагуляцією крові і інших колоїдних систем організму. Коагуляція розчинів залежить від наявності в колоїдній системі електролітів. Визначення порогу коагуляції дає розуміння будови колоїдних частинок і є критерієм агрегативної стійкості дисперсних систем.
Навчальні цілі:
Знати: будову міцели колоїдних частинок, причини виникнення коагуляції, методи проведення коагуляції і запобігання процесу коагуляції.
Вміти: визначати поріг коагуляції, заряд колоїдних частинок. Застосувати процес коагуляції для очистки питної води.
Самостійна позааудиторна робота студентів.
1. Електрокінетичні явища. Досліди Ф. Рейса.
2. Теорії будови подвійного електричного шару.
3. Чим обумовлена стійкість колоїдних розчинів.
4. Електрокінетичний потенціал.
5. Використання електрофоретичних методів в медицині.
6. Коагуляція під дією електролітів. Правило Шульце-Гарді.
7. Поріг коагуляції і його визначення.
8. Теорії стійкості і коагуляції.
9. Колоїдний захист. Його визначення в біології і медицині.
Контрольні питання.
- Що таке коагуляція? Її ознаки.
- Які фактори викликають коагуляцію?
- Що таке поріг коагуляції?
- Правило Шульце-Гарді.
- Залежність швидкості коагуляції від концентрації електроліта.
- Залежність швидкості коагуляції від заряду електроліта.
- Чим зумовлена стійкість колоїдних розчинів?
- Будова подвійного електричного шару.
- Електрокінетичний потенціал.
- Електроосмос.
- Електроферез.
- Використання електрофоретичних явищ в медицині.
- Взаємна коагуляція золів.
- Що таке пептизація?
- Розрахуйте поріг коагуляції золю (СП), якщо до 5 мл золю гідроксиду заліза додати 2 мл води і явна коагуляція наступила при додаванні 3 мл 0,01 М розчину К2SO4.
- Пороги коагуляції деякого гідро золю рівні СП(СаСІ2)=0,3 ммоль/л, СП(К2SO4)=0,0299 ммоль/л. Який по знаку заряд несуть частинки золю?
- Які йони електролітів Na2SO4 чи K4[Fe(CN)6] є коагулюючими для гідро золю гідроксиду заліза, одержаного методом гідролізу.
- Коагулююча роль якого із електролітів Na2SO4 чи MgCI2 , буде сильніший при дії на золь йодиду срібла, одержуваного змішуванням рівних об’ємів нітрату срібла з С=0,01 моль/л і йодиду калію з С=0,015 моль/л.
- Визначте знак заряду частинок золю, якщо при коагуляції його електролітами одержані такі пороги коагуляції в ммоль/л: СП(MgCI2)=300, СП(КNO3)=320, СП(Na3PO4)=0,6.
- Який мінімальний об’єм К2Сr2О7 з С=0,01 моль/л необхідно для коагуляції 1 л золю гілроксиду заліза одержаного методом гідролізу. Поріг коагуляції 0,06 ммоль/л
Самостійна робота на занятті.
Виконати лабораторні роботи:
- Визначення знаку заряду частинок методом капіляризації.
- Визначити поріг коагуляції золю гідроксиду заліза.
- Очистка води коагуляцією.
Методика виконання роботи
Робота 1. Визначення знаку заряду частинки методом капіляризації.
На полоску фільтрувального паперу нанести краплю досліджуваних розчинів (золів, розчинів барвників, суміші барвників). Визначити знак заряду частинок, вважаючи, що папір має від’ємний заряд.
Робота 2. Визначення порогу коагуляції.
Заповнити одну бюретку розчином дихромату калію (с( 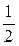 K2Cr2O7)=0,002 моль/л), а другу – розчином гексаціаноферату (ІІІ) калію (с(
K2Cr2O7)=0,002 моль/л), а другу – розчином гексаціаноферату (ІІІ) калію (с( 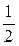 K3[Fe(CN)6])=0,002 моль/л). У дві пробірки за допомогою піпетки внести по 5 мл золю гідроксиду заліза (ІІІ). Додати в одну з пробірок, по краплях, добре перемішуючи, розчин дихромату калію, а в другу – розчин гексаціаноферату (ІІІ) калію до помутніння розчину (коагуляція золю).
K3[Fe(CN)6])=0,002 моль/л). У дві пробірки за допомогою піпетки внести по 5 мл золю гідроксиду заліза (ІІІ). Додати в одну з пробірок, по краплях, добре перемішуючи, розчин дихромату калію, а в другу – розчин гексаціаноферату (ІІІ) калію до помутніння розчину (коагуляція золю).
Обчислити поріг коагуляції кожного з електролітів (в ммоль/л) за формулою:
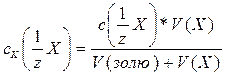
Обчислити коагулюючу здатність електролітів (в л/моль) за формулою:
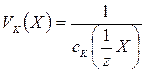
Обчислити відносну коагулюючу здатність електролітів.
Результати занести в таблицю.
| Електроліт | Молярна конце-нтрація еквівале-нта електроліту, 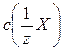 , ммоль/л , ммоль/л | Об’єм роз-чину елек-троліту, V(X), л | Коагулюючий йон | Поріг коагуляції, ммоль/л | Коагулююча здатність, VK(X), л/моль |
| K2Cr2O7 | |||||
| K3[Fe(CN)6]) |
Робота 3. Очистка води коагуляцією.
В 6 пробірок налити по 5 мл мутної води і в кожну добавити різну кількість краплин золя гідроксиду заліза (1,2,3,4,8,16). В 7 пробірку налити 5 мл мутної води для порівняння. Спостерігати за змінами в пробірках. Зробити висновки.
Література
- Клименко А.О., Мельник М.В., Павлюк В.М., Нечитайло Л.Я., Хопта Н.С., Коцаба М.В. Навчально-методичний посібник з фізичної та колоїдної хімії для студентів вищих медичних навчальних закладів. Івано-Франківськ, 2004.
- Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія, Вінниця, «Нова книга», 2006.
Підготувала: асистент кафедри Хопта Н.С.
Обговорено і затверджено
на засіданні кафедри
протокол №1 від 28.08.20012р.
Зав. кафедрою біологічної та медичної хімії проф. А.М.Ерстенюк
ЗАНЯТТЯ №22
