Апаратура та техніка виконання якісного хімічного аналізу
Якісний хімічний аналіз виходячи з багатьох міркувань доцільно проводити за напівмікрометодом. За цим методом необхідні порівняно малі кількості досліджуваної речовини. Так, для проведення систематичного ходу аналізу береться всього 1-1,5см3 досліджуваного розчину, в якому може бути тільки декілька міліграмів йонів, які визначаються, а деякі досліди проводять з краплями розчину, що містять частки міліграма досліджуваних йонів.
Як і макроаналіз, напівмікроаналіз по суті є пробірочним аналізом. Крім основних пробірочних реакцій відділення і виявлення йонів у напівмікроаналізі широко застосовуються і інші реакції – реакції забарвлення полум’я, механохімічні, мікрокристалоскопічні, крапельні.
Для напівмікрометоду застосовуються у відповідності з дозами речовин апаратура та техніка роботи.
Малі дози речовин визначають необхідні для роботи малі кількості реактивів. Більша частина найбільш вживаних реактивів, крім концентрованих кислот, лугів, розчинів амоніаку та інших токсичних речовин, розміщується у спеціальних ящиках-штативах (рис.). Ящик має гнізда для пляшечок з рідкими та твердими реактивами. Доцільно для цієї мети застосовувати флакончики з-під лікарських препаратів. У гумових корках цих флакончиків робиться отвір, в який вставляється медична піпетка (очна). У нижній частині ящика-штатива є два висувних ящика для різного лабораторного приладдя – піпеток, для предметного скла мікроскопа, тримачів для пробірок, скляних паличок, порцелянових чашок, порцелянових пластинок, тиглів, штативів для мікропробірок та інше.
Слід пам’ятати, що успіх у проведенні аналізів залежить від чистоти реактивів. При внесенні реактиву у посудину з досліджуваним розчином за допомогою піпетки не можна торкатися внутрішніх стінок посудини, а, тим більше, занурювати піпетку з реактивом у досліджуваний розчин, оскільки це неминуче призведе до забруднення реактиву у ящику-штативі.
В основі якісного хімічного аналізу лежать реакції осадження йонів дією групових реагентів , що забезпечує таким способом їх розділення на аналітичні групи. Осадження йонів у формі малорозчинних осадів ведуть у невеликих пробірках, які входять до комплекту лабораторних центрифуг.
Осадження слід проводити строго у визначених умовах: температура, рН, концентрація реактивів та інше. Для повноти осадження, зазвичай, беруть невеликий надлишок йона-осаджувача.
Надлишку реактиву, що може викликати часткове або повне розчинення осаду, що утворився, брати не слід. Інакше при швидкому додаванні надлишку реагенту осад взагалі може не утворитися.
Якщо необхідні умови не виконуються, то при цьому буде недостатньо повне розділення йонів, що викликатиме труднощі при подальшому проведенні аналізу.
При проведенні осадження реактив-осаджувач слід додавати краплинами, ретельно перемішуючи реакційну суміш скляною паличкою після кожного додавання реактиву.
Після осадження певного йона чи групи йонів у вигляді малорозчинної сполуки осад повинен бути найбільш повно відділений від рідкої фази. Це досягається центрифугуванням, яке забезпечує швидке та достатньо повне відділення осаду від рідини. Рідка фаза над осадом називається центрифугатом.
Центрифужну пробірку можна заповнювати сумішшю не більше як на ⅔ її висоти. Якщо суміші буде більше, то при установці пробірки в ротор центрифуги під кутом частина суміші буде виливатись.
В лабораторній центрифузі (тип ЦЛН-2) є 6 гнізд для пробірок. Така центрифуга може мати швидкість обертання ротора до 6000 об/хв. При цьому розвивається відцентрова сила, при якій пробірка із сумішшю може досягати маси у декілька кілограмів. У зв’язку із цим визначальним є правильне завантаження центрифуги. У всіх пробірках маси сумішей мають бути однаковими. Протилежні гнізда центрифуги повинні бути рівномірно навантажені. Якщо число пробірок із сумішшю для центрифугування непарне, то в пробірку, що виконуватиме роль противаги, вносять воду відповідної маси. Категорично забороняється центрифугувати непарну кількість пробірок. При великих швидкостях обертання ротора центрифуги у такому випадку можлива поломка осі ротора, що призводить до руйнування центрифуги, виліт ротора з великою силою. Перед подачею електричної напруги на двигун центрифуги ротор центрифуги слід штовхнути рукою, щоб він зробив декілька обертів. Напругу слід подавати повільно, ступінчаcто, в міру підвищення швидкості обертання ротора. При різкій подачі напруги при нерухомому роторі електродвигун центрифуги може згоріти. При роботі центрифуги ротор повинен бути закритий кришкою, яку не можна знімати до повної зупинки центрифуги.
З несправною центрифугою працювати забороняється.
Якщо під час роботи центрифуги відчувається вібрація чи шум, то це означає, що центрифуга була завантажена нерівномірно, за відсутності рівності мас протилежних плечей. У даному разі центрифугу необхідно негайно вимкнути, діждатись її повної зупинки та усунути причини вібрації.
За швидкості обертання ротора центрифуги 5000 об/хв. через
3 хвилини осад у більшості випадків щільним шаром зосереджується на дні пробірки.
Після повної зупинки центрифуги пробірки виймають з гнізд. Перехилянням пробірки догори дном зливають центрифугат. При цьому осад міцно тримається на дні пробірки і не випадає з неї при перехилянні пробірки.
Якщо ж осад під час центрифугування погано ущільнився, що буває дуже рідко, то тоді центрифугат відбирають піпеткою, намагаючись не скаламутити осад. Якщо ж осад все ж таки потрапив у піпетку при відборі центрифугату, то такий центрифугат можна повторно поставити на центрифугування для остаточного відділення осаду від розчину.
Якщо частинки осаду дуже дрібні або дуже легкі , то в такому випадку центрифугування не дає добрих наслідків. У такому разі застосовують фільтрування. Краще застосовувати фільтрування під вакуумом. У лійку вміщують щільний фільтр (іноді подвійний). На фільтр за допомогою скляної палички вносять скаламучену рідину. Лійку через гумовий корок ставлять в колбу Бунзена, яку приєднують до вакуум-насоса, і рідину профільтровують у пробірку, яку ставлять у колбу Бунзена під лійку.
Після відділення від центрифугату осад необхідно відмити відповідним розчином оскільки він ще просочений значною кількістю маточного розчину. До осаду для його промивання додають 2-3см3 промивної рідини, ретельно перемішують осад скляною паличкою. Центрифугують, відділяють від осаду промивну рідину. Промивання повторюють ще принаймні двічі. Перша порція промивної рідини приєднується до центрифугату, а наступні відкидаються.
Промивання осаду, зібраного на фільтрі, здійснюють за допомогою промивальниці. Потік промивної рідини з промивальниці направляють на осад, що промивається.
Більшість хімічних реакцій, які застосовуються в якісному аналізі, відбуваються швидко вже при кімнатній температурі. Але інколи все ж таки доводиться нагрівати реакційну суміш для прискорення реакцій, укрупнення кристалів осаду, видалення летких компонентів суміші, розчинення осадів і таке інше.
У зв’язку з тим, що у напівмікроаналізі працюють з малими кількостями речовин, нагрівання на полум’ї пальника проводять рідко, щоб не було перегріву чи розбризкування речовини. Краще нагрівати пробірку на водяній бані у спеціальних штативах. На водяній бані можна також упарювати розчин для збільшення концентрації досліджуваної речовини або випарювати до повного видалення розчинника до утворення щільного або сухого залишку. Упарювання та випарювання проводять у порцелянових чашках.
Для видалення амонійних солей, зазвичай, застосовують прожарювання попередньо висушеної речовини. Після повного випарювання розчину на водяній бані на кришці порцелянового тигля її поміщають у спеціально призначену для видалення амонійних солей холодну муфельну піч і поступово доводять температуру печі до 700-8000С. Прожарювання при такій температурі ведуть протягом 30-40 хв.
У якісному аналізі застосовують пірохімічні реакції виявлення деяких хімічних елементів. Пара деяких металів має певне забарвлення, що може бути аналітичним сигналом наявності у досліджуваній речовині цих металів. Реакції забарвлення полум’я проводять, зазвичай, з хлоридами, які є найбільш леткими солями. Для проведення цих реакцій кінчик платинової дротинки з вушком вносять у досліджуваний розчин , а потім – у безбарвне полум’я газового пальника. Дротинка повинна бути попередньо очищена шляхом багаторазового змочування хлоридною кислотою і наступного прожарювання до тих пір, доки вона не перестане забарвлювати полум’я. Не рекомендується проводити такі реакції забарвлення полум’я з твердими речовинами, оскільки при цьому часто відбувається забруднення дротинки, яке важко усунути.
За цим методом не можна користуватись кіптявим (відновленим) полум’ям, оскільки при цьому утворюється крихка вуглецева платина. Для проведення реакцій забарвлення полум’я слід застосовувати пальники, що дають високу температуру – порядку 15000С. При недостатньо гарячому полум’ї не можна виявити навіть ті хімічні елементи, які мають низькі потенціали йонізації.
У якісному аналізі як реагенти чи продукти реакцій можуть бути гази. Так, наприклад, виділення таких газів, як CO2, SO2, H2S, NO2, NH3 свідчить про наявність у досліджуваному об’єкті певних йонів (CO32–, SO32–, S2–, NO3−, NH4+).
За винятком вуглекислого газу, всі інші гази токсичні і вимагають дотримання правил техніки безпеки. Реакції, пов’язані із застосуванням газів як реагентів чи з виділенням газів, слід обов’язково проводити у витяжній шафі.
Особливо токсичним є H2S. Вдихання чистого H2S призводить до смерті, яку не можна попередити ніякими засобами. Невеликі дози сірководню викликають серйозні хронічні отруєння. Навіть дуже невеликі кількості H2S, які потрапляють з витяжної шафи в атмосферу лабораторії через недбалість працюючих та ігнорування ними правил техніки безпеки, викликають у людей отруєння: запаморочення, головний біль, нудоту, зниження працездатності.
При роботі у витяжній шафі необхідно слідкувати за тим, щоб була необхідна тяга, дверцята шафи максимально зачинені. У витяжній шафі можуть бути тільки руки працюючого. Не можна виносити з шафи навіть на короткий час посудини, з яких виділяється гідроген сульфід.
Залишки розчинів, що містять H2S чи сульфіди лужних металів та амонію, не можна зливати у каналізаційні раковини. Вони повинні зливатись у спеціальні склянки з розчинами, які зв’язують сульфід-іони у малорозчинні сполуки, такі, що не гідролізуються (наприклад: S2– + Cu2+ → CuS).
При роботі за напівмікрометодом гази в результаті реакцій виділяються у незначній кількості. У зв’язку із цим, слід звернути увагу на те, щоб газ, який виділяється, по можливості повніше діяв на реактивну рідину чи смужку індикаторного паперу.
У якісному аналізі дуже велике значення мають мікрокристалоскопічні реакції. Їх доцільно застосовувати для виявлення тих йонів, які погано виявляються шляхом реакцій у розчинах (Na+, Mg2+, Ca2+, Zn2+ та інші).
Сутність мікрокристалоскопічного методу полягає у тому, що на предметне скло мікроскопа наносять краплю досліджуваного розчину, а поряд з нею краплю реактиву. Потім за допомогою скляної палички з’єднують обидві краплі містком. У граничних зонах обох крапель відбувається хімічна реакція, в результаті якої утворюється малорозчинна речовина з кристалами характерної форми та забарвлення, які і розглядають під мікроскопом. При проведенні реакції таким шляхом зберігаються незначні концентрації реагуючих речовин, тому утворюються крупні добре сформовані кристали.
Недоліками мікрокристалоскопічного методу є те, що вони вимагають строго виконання певних умов. Крім того, домішки інших речовин часто заважають проведенню цих реакцій, оскільки випадають кристали інших речовин і результати стають непередбаченими.
Позитивним є можливість працювати швидко та з малими дозами речовин.
У деяких випадках для збільшення концентрації досліджуваного розчину рекомендується нагрівати предметне скло з нанесеною на нього краплею розчину, проте сильно нагрівати не можна. При перегріванні предметного скла розчинника випаровується більше, ніж це потрібно. Тому викристалізовується не тільки малорозчинна речовина, яка повинна утворитися в результаті даної реакції, а також і сторонні домішки та надлишок реактиву. Все це призводить до того, що кристали домішок та реактиву у певній мірі, а інколи і повністю заважають розпізнаванню кристалів очікуваної малорозчинної речовини.
Перед тим, як розглядати кристали під мікроскопом, його слід підготувати до роботи. Дивлячись в окуляр мікроскопа, необхідно встановити дзеркало так, щоб поле зору було добре і рівномірно освітлене. Потім гвинтом грубої наводки тубус мікроскопа опускають якомога нижче до предметного скла, дивлячись при цьому не в окуляр, а збоку. Об’єктив ні в якому разі не повинен торкатися реакційної суміші на предметному склі. Якщо об’єктив все ж таки торкнувся рідини на предметному склі, то його слід підняти і лінзи об’єктива ретельно протерти фільтрувальним папером. Встановивши тубус мікроскопа у вихідне положення, повільно піднімають його за допомогою гвинта грубої наводки, дивлячись при цьому в окуляр мікроскопа, до досягнення чіткості зображення. При необхідності за допомогою мікрометричного гвинта тонкої наводки досягають найбільш чіткого фокусу. Переміщуючи предметне скло за допомогою відповідних гвинтів, які змінюють положення стола мікроскопа, знаходять найбільш характерні частини об’єкту з правильно сформованими кристалами досліджуваної речовини. Змінюючи положення дзеркала можна змінювати умови освітлення об’єкта, що дає можливість більш детально виявити контури кристалів. Побачене під мікроскопом слід обов’язково порівняти з малюнками кристалів цієї речовини, а також порівняти отримані кристали чистої даної речовини, отриманої при взаємодії чистих (індивідуальних) досліджуваних йонів з чистим реагентом.
При роботі з мікроскопом слід дотримуватись правил роботи із ним:
– столик мікроскопа повинен бути завжди чистим, не
поміщати на нього мокрі предметні скельця;
– як джерелом світла не можна користуватись прямим
сонячним світлом (сонячним зайчиком);
– після того, як тубус мікроскопа перед вивченням об’єкта
опущений за допомогою гвинта грубої наводки у вихідне
положення, його можна лише підіймати.
Якщо об’єкт не вдалося помістити у поле зору з першого разу, то груба наводка знову повторюється з вихідного найбільш низького положення тубуса.
Для підтвердження правильності виявлення йона в якісному хімічному напівмікроаналізі застосовують крапельні реакції. Крапельний аналіз ґрунтується, головним чином, на капілярно-адсорбційних явищах. Засновником цього методу є М.О.Тананаєв.
Суть крапельного аналізу в тому, що в результаті взаємодії крапель досліджуваного розчину та реактиву на фільтрувальному папері або порцеляновій пластинці виникає забарвлена у певний колір пляма, поява якої свідчить про наявність певного йона. Зазвичай у крапельному аналізі застосовується фільтрувальний папір. Завдяки певним особливостям фільтрувального паперу стає можливим проведення крапельних реакцій. У результаті адсорбції на волокнах фільтрувального паперу йонів, які досліджуються, та реактиву, збільшується їх концентрація, що значно підвищує чутливість реакції. Завдяки фільтруючій дії паперу різні складові частини розчину розташовуються у різних концентричних шарах плями, в результаті чого йони, які виявляються, можуть бути виявлені крапельним же шляхом у відповідній зоні плями, тобто, при цьому попутно відбувається розділення йонів і, таким чином, неспецифічна реакція стає специфічною.
Техніка виконання крапельних реакцій полягає у наступному. У капіляр набирається стільки досліджуваного розчину, щоб з його кінця не звисала крапля; для цього достатньо занурити капіляр у рідину і дати їй вільно піднятися під дією капілярних сил. Потім кінцем капіляра торкаються фільтрувального паперу, щоб на ньому утворилася пляма діаметром 2-3мм. Далі іншою піпеткою, заповненою реактивом, торкаються паперу в центрі утвореної плями настільки, щоб реактив лише просочив раніше утворену пляму. Утворена при цьому кольорова пляма свідчить про наявність йонів, які виявляють. У тих випадках, коли при крапельних реакціях йони, що заважають, зосереджуються в центрі плями, а йони, які виявляють, проникають на її периферію, папір змочують реактивом на йони, які виявляють, безпосередньо навколо плями. При цьому утворюється забарвлене кільце.
Якщо досліджуваний йон міститься у розчині в незначній кількості і одноразове нанесення краплі цього розчину буде недостатнім, то в даному разі застосовують послідовне декілька разове нанесення на фільтрувальний папір крапель досліджуваного розчину та реактиву, дотримуючись вищенаведеної техніки. Таким способом можна підвищити чутливість реакції та виявити навіть дуже незначні кількості досліджуваних йонів.
Для запобігання забруднення реактивів слід після контакту капілярної піпетки з вологою плямою на фільтрувальному папері доторкнутися кінцем піпетки до чистого фільтрувального паперу, в результаті чого кінчик піпетки буде відмитий від забруднень реактивом, що витікає з піпетки.
Для крапельних реакцій слід застосовувати товстий та пухкий фільтрувальний папір, який здатен добре всмоктувати рідину. Необхідно строго дотримуватись рекомендованого порядку нанесення на фільтрувальний папір крапель досліджуваного розчину та реактивів.
Основною перевагою крапельних реакцій є те, що вони дуже чутливі, потребують для їх виконання мало часу (порядку декількох хвилин) та дуже малих кількостей досліджуваних об’єктів та реактивів.
В якісному хімічному напівмікроаналізі застосовуються достатньо чисті реактиви: ч.д.а. – чисті для аналізу або х.ч. – хімічно чисті. Так, наприклад, у розчинах хлоридної кислоти марки ч.д.а. вміст домішок йонів SO42– не повинен перевищувати 5∙10–4 г/дм3, а йонів Fe3+ – 1∙10–4 г/дм3. У розчинах цієї кислоти марки х.ч. вміст домішок не повинен перевищувати 2∙10–4-5∙10–5 г/дм3.
Знаючи концентрацію реагенту в розчині, за числом взятих крапель можна мати уявлення про кількість внесеного реагенту. Об’єм краплі для більшості розчинів можна прийняти рівним 0,05см3 у залежності від діаметра капіляра піпетки.
Для якісного, а також і для кількісного, аналізів застосовується вираження концентрації речовини в розчині як молярна концентрація еквівалента:
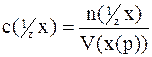 моль/дм3,
моль/дм3,
оскільки речовини взаємодіють між собою в еквівалентних співвідношеннях. Розчини однакової молярної концентрації еквівалента вступають в реакцію між собою в однакових об’ємах. Якщо розчини реагуючих речовин мають не однакові молярні концентрації еквівалента, то розчинів з меншою концентрацією слід взяти в більшому об’ємі, ніж реагуючого з ним розчину з більшою концентрацією.
Для повного осадження певного йона треба не еквівалентна кількість розчину йона-осаджувача, а деякий його надлишок, щоб добуток концентрації осаджуваного йона і йона-осаджувача був більшим добутку розчинності утвореного малорозчинного продукту реакції. Тобто осад починає випадати з пересичених розчинів.
Молярна концентрація еквівалента розчину прямо вказує на те, які об’єми розчинів слід брати для виконання тієї чи іншої реакції. У більшості випадків застосовують розчини реагентів з молярними концентраціями еквівалента 0,2-0,5моль/дм3 і лише в деяких випадках з іншими концентраціями, про що вказується окремо.
