Ферменттердің жалпы сипаттамасы. Ағза торшаларының тіршілік етуі, қызметі, оларда өтетін химиялық реакция өнімдерінің түзілуі
Ағза торшаларының тіршілік етуі, қызметі, оларда өтетін химиялық реакция өнімдерінің түзілуі жылдамдығына тәуелді процесс. Реакция жылдамдығы оларға әсер етуші заттар - катализаторларға тығыз байланысты. Катализатор реакцияға қатысып, оның жылдамдығын жоғарылатады және реакция соңында бастапқы қалпына келеді.
Ферменттер торшаларда синтезделіп, биохимиялық реакцияларға қатысатын белоктық табиғаттағы биокатализаторлар.
Энзимология — ферменттерді зерттейтін ғылым саласы. Ол басқа ғылымдар биология, генетика, фармакология, химиямен тығыз байланысты.
Фермент немесе энзим (лат. fermentum — ашу; en — ішінде, zim — ашытқы Ван Гельмонт, 19 ғ. ұсынған) алғашқыда ашыту процестерінде анықталған зат.
Ферменттердің қызметі туралы алғашқы ғылыми еңбекті Кирхгофф (1814) жариялады. Кейін ашу процесі ашытқы торшаларында ғана өтеді деген ұйғарым жасаған Л. Пастерге (1871), Либих ферменттер торшалардың өмір сүруіндегі пайда болған өнім ол торшада да, олардан бөлек те қызмет атқарады деген қарсы пікір білдірді. Либихтің ғылыми көзқарасы М. Манассейна (1871), Бухнер (1897) зерттеулерінде эксперимент жүзінде дәлелденді.
Торшаларда синтезделген ферменттер өзіне тән арнайы қызметте-
рін ағзаның барлық мүшелерінде атқарады. Олардың табиғаты белок екені Зеренсон (1909), И.П. Павлов — пепсинді зерттеуінде, А.М. Данилевский — ферментті (липазаны) талғамды бөліп алуы, Самер (1926) — уреазаны кристалл түрінде алғаш алуы, Нортроп (1930) — пепсин, трипсинді таза күйінде бөліп алуы еңбектері негізінде дәлелденді. Ферменттік қасиет, негізінен, глобулалық құрылымдағы белоктарға тән екені белгілі болды. Бірақ, қазіргі кезде, кейбір құрылымдық белоктар да (фибриллалық белоктар — актин, миозин) каталиттік активтілік көрсететіні байқалған.
Ферменттер белоктарға тән физика-химиялық қасиеттерді байқатады. Сондықтан олар коллоидтық ерітінділер түзеді, молекулалық массасы 10000-нан, бірнеше млн далтон аралығында болады, ертінділері амфотерлік электролиттік қасиет көрсетеді. Кристаллдарының құрамында су молекуласы болады, ал толық сусызданған фермент кристаллы каталиттік активтілігін жоғалтатыны байқалған. Кеңістікте ұйымдасқан құрылымдық конформациясы бойынша белоктық глобулалық және фибриллалық формаларды қайталайды. Сонымен бірге, ферменттердің өзіне тән кейбір қасиеттеріне олардың термолабилділігі, әсер ету ерекшелігі, активтілігінің реттелуі жатқызылады.
Ферменттік реакция. Ферменттер өз әсерлерін микрогетерогендік (өте аз мөлшерде) катализаторға ұқсас жүргізеді. Фермент өзінің әсер етуші заты субстратпен (S) ферменттік реакция жүргенде фермент-субстрат комплексін (аралық зат) түзеді. Бұл комплекстің қызметі өте күрделі, ол субстрат пен фермент молекулаларының конформациялық өзгеруі, энергия өзгерістері және химиялық байланыстар өзгерулеріне әкеледі. Реакция өткеннен соң фермент-субстрат комплексі жаңа қалыпқа ауысып фермент-реакция өнімі комплексіне айналады. Содан кейін ол фермент және реакция өніміне (Р) жекеленіп бөлінеді
S + E → S·E → EP → E + P
Жай химиялық реакциялардан катализдік реакцияның айырмашылығы тәріздес бейорганикалық катализатор мен биокатализатордың да өзіндік ерекшеліктері болады.
 Ферменттердің катализаторлық ерекшелігіне келесі қасиеттері жатқызылады:
Ферменттердің катализаторлық ерекшелігіне келесі қасиеттері жатқызылады:
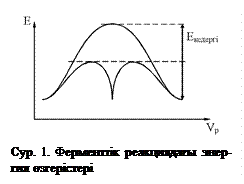
а) Фермент өздігінен жаңа реакция жүргізбейді. Ол тек термодинамикалық мүмкін реакцияны ғана жүргізеді. Реакция барысында активтелу энергиясы төмендейді. Графикте көрсетілгендей реакцияның үлкен кедергі энергиясын сатылап бөліп төмендету және активтелу энергиясын жоғарлату арқылы реакция жылдамдығын жоғарлатады.
б) Фермент басталған реакцияның бағытын өз бетінше өзгерте алмайды. Ол бір ғана реакция өнімі түзілуі бағытында жұмыс істейді. Мысалы, глюкокиназа глюкозадан тек глюкоза-6-фосфат түзілуін жүргізеді.
в) Фермент қатысатын реакция қайтымды болса, ол реакцияны екі бағытта да жүргізе алады. Мысалы, көмірсулардың гликолиттік ыдырауына қатысатын фосфогексоизомераза, альдолаза, фосфоглицераткиназа, фосфоглицератлидаза және т.б.
г) Фермент реакцияға өте аз мөлшерде қатысады. Ферменттің бір молекуласы 1 минутта 1000-нан млн-ға дейін субстрат молекуласына әсер ете алады. Бұл көрсеткіш карбангидраза ферментінде 36 млн-ға дейін жетеді.
д) Фермент реакция өткеннен соң өзінің бастапқы қалпына қайта келеді. Сондықтан ол субстраттың жаңа молекуласына әсер етуге қашанда дайын болады.
е) Ферментативті реакцияның жоғарғы активтілігі оның реакцияны бейорганикалық катализаторлардан да жоғары жылдамдықта жүргізе алатындығы. Мысалы, белоктың аминоқышқылдарға дейінгі гидролиттік ыдырауын бейорганикалық катализатор (күшті қышқыл, сілті қатысуында) жоғары температурада (Т = 100° С) бірнеше сағатта жүргізсе ферменттер төменгі температурада (Т = 30—40° С) бірнеше минутта жүргізеді.
ж) Арнайы субстраттық ерекшелігінің өте жоғары дәрежелілігі. Фермент реакциялық қоспадан реакция өнімін беретін субстратты таңдай алады және тек сонымен ғана реакцияға түседі.
з) Ферментативті реакцияны реттеуге болатындығы. Бұл фермент молекуласында болатын активті орталыққа, субстрат мөлшеріне, фермент мөлшеріне, ортаның факторларына (рН, Т, қысым) байланысты. Сондықтан торшаларда мыңдаған реакциялар белгілі бір ретпен және қажеттілігіне сәйкес жүреді.
Ферменттердің құрылымдық ұйымы. Химиялық құрылысы бойынша ферменттер протеин (жай белоктар) және протеид (күрделі белоктар) болып бөлінеді. Фермент-протеиндердің активтілігі сол белоктың құрылымына байланысты. Фермент-протеидтердің активтілігі белоксыз табиғаттағы топ — кофакторға тығыз байланысты. Күрделі құрылыстағы ферментті — фермент-протеид, қос компонентті немесе холофермент, ал оның белоктық бөлігін белоктық компонент, немесе феррон (алып жүруші), немесе апофермент және қосымша топты простетикалық топ, немесе агон (активті топ), немесе кофермент (кофактор) деп атайды. Простетикалық топтың ерекшелігі ол апоферментпен мықты байланысады және ажыратылмайды. Мысалы, цитохром С-дағы гемдік топ белокпен ковалентті байланысқан, кофермент апоферменттен жеңіл бөлінеді, бірнеше ферментке қызмет ете алады және өз бетінше де өмір сүре алады. Ол коваленттік байланысқан болады. Простетикалық топтарға және коферментке витаминдердің туындылары, нуклеотидтер және олардың туындылары, кейбір моносахаридтердің фосфорлық эфирлері, тетрапирролдар мен металл құрамды порфириндер, глутатион (пептидтер) жатқызылады.
Кофактор (кофермент) апоферменттің каталиттік активті конформациясының (ү.р.қ. немесе т.р.қ.) тұрақты қалыптасуын камтамассыз етеді. Активті орталықтың құрамына кіріп, катализге тікелей қатысады, апоферменттің әсер ету ерекшелігіне ықпал етеді. Апофермент ферменттің өзіне тән субстраттық ерекшелігі мен жоғары каталиттік активтілігін қамтамассыз етеді. Сондықтан апофермент пен кофермент байланыспаған болса фермент өзінің каталиттік қызметін атқара алмайды.
Ферментте каталиттік қызметті кофермент атқарады. Оның әсері белоктық полипептидтік фрагменттің қатысуынсыз жүрмейді.
Коферменттердің қызметі олардың электрондарды аралық тасымалдауда, кейбір атомдар мен қызметік топтарды (—H; —NH2; —CH3 және т.б.) бір қосылыстан екіншіге ауыстыру болып табылады. Нәтижесінде химиялық өзгерістер өтеді, жаңа өнім пайда болады.
Коферменттері-витаминдер (В1, В2, В3, В5, В6, В12, Н, Вс) немесе олардың туындылары (КоА, НАД, НАДФ, ФМН, ФАД) болатын ферменттер әртүрлі маңызды реакцияларды жүргізеді.
Пептидтердің коферменттік қасиеті олардың, мысалы, глутатион-SH (γ-глутамилцистеинилглицин) торшалардағы өтетін тотығу-тотықсыздану процесстеріне қатысуымен байланысты.
Нуклеотидтер мен олардың, туындыларының (аденозиндік, гуанозиндік, уридиндік, цитидиндік) коферменттік қызметі АТФ-тың фосфаттық қалдығы мен аденинді, фосфоаденозинфосфосульфаттың (ФАФС) — сулфаттық топты, S-аденозилметиониннің — метилдік топты, УДФ-тің — гликозилдік қалдық пен урон қышқылын, УДФ-тің — фосфохолинді тасымалдаушы заттары ретінде болуымен байқалады.
Металл иондарының коферменттік қызметі субтрат пен фермент арасында «көпір» тәріздес байланыс құруы арқылы және каталиттік қызметке тікелей қатысуы арқылы белгілі.
Сонымен бірге, кейбір моносахаридтердің фосфорлық эфирлері, липой қышқылдары және т. б. көптеген заттарда коферменттік қызметі атқаратындығы белгілі болды.
Бір ғана кофермент әртүрлі белоктарға байланысып әртүрлі реакцияларды катализдеуі мүмкін. Пиридоксальфосфат бір жағдайда трансаминденуді жүргізеді.
Бір компонентті ферменттердің (фермент-протеин) каталиттік қызметі құрылымында активтік каталиттік субстраттық, аллостерлік орталықтардың болуымен тығыз байланысты.
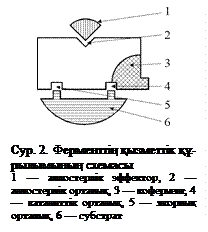 Активті орталық. Фермент молекуласының полипептидтік тізбегі құрамындағы активті орталық белгілі бір аминоқышқылдардың ерекше жинақталған түрлері. Активті орталықтың құрамында негізінен серин, тирозин, гистидин, триптофан, аргинин, цистеин, аспарагин және глутамин қышқылдары кездеседі. Бұл аминоқышқылдардың радикалдары күрделі ферменттердегі кофермент тәріздес қызмет атқарады. Ферменттің активті орталығы белоктағы полипептид тізбегінің әртүрлі бөліктерінде орналасқан болады. Активті орталықтың құралуы белок молекуласының ү.р.қ. және т.р.қ., конформациялық деңгейлеріне қалыптасқанында өтеді.
Активті орталық. Фермент молекуласының полипептидтік тізбегі құрамындағы активті орталық белгілі бір аминоқышқылдардың ерекше жинақталған түрлері. Активті орталықтың құрамында негізінен серин, тирозин, гистидин, триптофан, аргинин, цистеин, аспарагин және глутамин қышқылдары кездеседі. Бұл аминоқышқылдардың радикалдары күрделі ферменттердегі кофермент тәріздес қызмет атқарады. Ферменттің активті орталығы белоктағы полипептид тізбегінің әртүрлі бөліктерінде орналасқан болады. Активті орталықтың құралуы белок молекуласының ү.р.қ. және т.р.қ., конформациялық деңгейлеріне қалыптасқанында өтеді.
Радикалдардағы қызметші топтар кеңістікте қозғалып каталиттік процесс өтетін орынға молекуланы глобус формасына айналдырып жиналады. Катализ жүруі үшін қызметші топтар қатаң түрде субстрат молекуласының реакция жүретін бөлігіндегі топтарына сәйкес келуі қажет. Әртүрлі факторлар әсерінен болатын үшінші және төртінші конформациялық деңгейлердің өзгеруі активті орталықтың өзгеруіне, сондықтан каталиттік активліктің өзгеруіне әкеледі.
Активті орталық қызметі әртүрлі екі бөлімнен тұрады: жанастырушы (якорлық) және каталиттік орталықтар.
Жанастырушы орталық. Жанастырушы орталық деп фермент молекуласындағы каталиттік реакцияға түсетін затты (субстратты) байланыстыруға жауап беретін бөлім.
Субстраттың фермент молекуласына бекітіліп орналасуы жанасу арқылы жүреді. Жанасатын бөлімдегі аминоқышқылдар радикалдары фрагментін «якорлық алаң» деп айтады. Жанастырушы орталықтың аминоқышқылдық құрам әр фермент үшін әртүрлі екендігі байқалады. Субстраттың жанастырушы орталыққа бекітілуі ферменттік реакция түріне байланысты әртүрлі аралықта орналасқан аминоқышқылдармен атқарылады. Бекіту процессі лизин қалдығындағы екінші амин тобы, немесе глутамин қышқылындағы екінші карбоксил тобы, немесе цистеин қалдығындағы сульфгидрилдік топтардың әсерлесуі арқылы өтетіні анықталған. Жанастырушы орталықтың маңызды қызметіне оның субстраттың молекуласын ферментке мықты бекітуі және оның құрамындағы реакцияға қатысатын топтарды активті орталыққа қатаң түрде тура әкелуі жатқызылады. Жанастырушы орталық фермент-субстрат комплексінің қалыптасуын қамтамассыз етеді және катализдің жүруіне жағдай жасайды.
Каталиттік орталық. Активті орталықтың каталиттік бөлімінде субстраттың химиялық өзгерісі өтеді, реакция өнімі түзіледі. Каталиттік орталықтың қызметі химиялық құрылысына байланысты әртүрлі. Бір компонентті ферменттерде олар полипептидтік тізбектегі сол орталыққа жиналған аминоқышқылдар радикалдарының қызметші топтарына байланысты, қос компонетті ферменттерде бұл кофакторға, оның табиғатына байланысты жүреді.
Қызметші топтар мен кофактор ферменттік реакциялардың түрлері мен реакция өнімдерін айқындайды.
Активті орталықтың қызметін жүйкеден қозу процессін бұлшықетке беруде маңызды роль атқаратын зат ацетилхолинді ыдыратушы холинэстераза ферментінің реакциясының механизмінен байқауға болады.
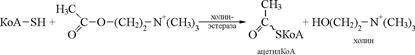
Холинэстеразаның активті орталығында серин, гистидин, тирозин және глутамин қышқылы болатыны анықталған.
Фермент-субстраттық комплекс ферменттегі глутамин қышқылы радикалындағы теріс зарядқа иондалған карбоксил тобы мен ацетилхолиндегі (субстрат) оң зарядтағы азот атомы арасындағы электрлік әсерлесу арқылы қалыптасады. Пайда болған комплексте серин радикалындағы (кофермент, КоА) сульфгидрилдік топ
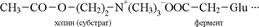
ацетилхолиннің карбонилдік тобымен әсерлеседі. Сонан кейін ацетилхолиндегі эфирлік байланыстағы оттегімен тирозин радикалының гидроксилдік топтары арасында әсерлесу өтеді. Сол себепті, ацетилхолин молекуласындағы карбонилдік топ пен эфирлік оттегі арасындағы байланыс әлсізденеді. Соның нәтижесінде ацетилхолин молекуласы активтеніп кедергілік энергиясы (Ек) төмендейді. Ары қарай гистидин радикалындағы оң зарядталған азот (N+) сериндегі сульфгидрилдік топтың протонын өзіне тартады. Бұл серин мен сірке қышқылы қалдығының арасында мықты байланыс түзілуіне жағдай жасап, ол тирозиннен бөлінген протонның холин қалдығына ауысуына әкеледі. Нәтижесінде ацетилхолин молекуласы екіге бөлінеді. Судағы сутегі мен гидроксил топтары арқылы ферменттің активті орталығы қайта қалпына келеді. Фермент-субстрат комплексі бір бірінен ажырайды.
Ферментердің жоғары каталиттік қабілеті қамтамассыз етіледі:
— ферменттер субстраттарды өзіне тартып, оларды активті орталыққа реакция өтетін орынға ыңғайлы бағыттап байланыстырады;
— ферменттегі қышқылдық, сілтілік топтар протонның субстратқа жеңіл ауысуына ыңғайлы орналасады;
— фермент молекуласындағы белгілі бір топтар субстратпен коваленті байланысып оның реакцияға қабілетті құрылысқа өтуіне жағдай жасайды;
— фермент субстрат молекуласында энергетикалық өзгерістерді өткізіп химиялық реакцияны жүргізеді.
Аллостерлік орталық. Фермент молекуласы әдетте активсіз күйде болады. Торша ішінде кездесетін кез келген кіші молекулалы заттар (витаминдер және олардың туындылары, металл иондары және т. б.) фермент молекуласының белгілі бір бөлігіне әсер еткенде ол активтелінеді. Активтендіруші заттарды аллостерлік эффектор, ал олар әсер ететін белоктағы полипептидтік бөлім аллостерлік орталық деп аталады. Аллостерлік орталық белоктың каталиттік қызмет атқара алатын ү.р.қ. және т.р.қ. денгейлері қалыптасуын қамтамассыз етеді.
Аллостерлік орталыққа әсер ететін заттарды екі топқа бөледі —активаторлар және ингибиторлар.
Активаторлар әсер еткенде белок молекуласы активті қалыпқа келеді. Ингибиторлар әсер етсе оның активтілігі тежеледі. Бұл процесс фермент активтілігінің реттелуінде маңызды роль атқарады. Қандайда бір затты активаторға немесе ингибиторға қатаң түрде жатқызуға болмайды. Активатор ретінде болған зат ингибитор ретінде де әсер ете алады, олар тек белгілі бір информацияны ғана бере алуы мүмкін. Ал қай кезде активті немесе пассивті формада болу фермент молекуласының ішкі құрылымдық механизмдеріне байланысты болуы мүмкін.
Активті-, жанастырушы-, аллостерлік орталықтар фермент молекуласының белгілі бір бөлімдері екендігі, шын мәнінде, шартты түрде қабылданған ұғымдар. Ферменттегі активті орталық, жанастырушы орталыққа сәйкес келуі де мүмкін. Немесе, аллостерлік орталықсыз да фермент активтілігі басқа факторлар арқылы да (құрылымдық деңгейінің өзгеруі, субстраттың жанастырушы орталыққа өздігінен байланысуы, қоршаған орта әсерлері) реттелуі мүмкін.
Фермент пен субстрат әсерлесуі олардың молекулалық құрылысының жалпы сәйкестілігіне (жалпы комплементарлылығына) тәуелді болады. Субстрат пен активті орталықтың аталған қасиетке бағынуы олардың әсерлесуін қамтамассыз ете алады.
