Моль. Эквиваленты и количество эквивалентов простых и сложных веществ. Способы выражения концентрации растворов.
В химическом анализе приходится иметь дело с измерениями количеств твердых веществ и концентраций растворов. Хорошо известно, что атомы и молекулы взаимодействуют в определенных пропорциях. Но непосредственно подсчитывать число атомов или молекул, участвующих в реакции, было бы неудобно. Для упрощения расчетов в химии было введено понятие моль. Один моль атомов, молекул, ионов или других частиц содержит количество частиц, равное числу Авогадро (6,022·1023).
Моль - количество вещества (n), в котором содержится число структурных частиц (молекул, атомов, ионов и др.), равное постоянной Авогадро (6,02-1023). При использовании моля как единицы количества вещества следует указывать вид частиц. Например: n(NaOH) = 2 моль - количество вещества, содержащего 2·6,02·1023 молекул NaOH; n (Са2+) = 0,5 моль - количество вещества, содержащего 0,5·6,02·1023 ионов Са2+.
Масса одного моля вещества называется молярной массой. Отсюда, масса вещества равна произведению количества вещества на молярную массу.
m = ν·M
В химии большое практическое значение имеют такие характеристики элементов (для атомов) или веществ (для молекул), как эквиваленты, или молярная масса эквивалента.
Расчет результатов основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой в эквивалентных количествах.
Если определяемое вещество A реагирует с вееством B по уравнению
νAA + νBB → Продукты реакции,
то эквивалентными массами веществ будут νAM(A) и νBM(B), где M(A) и M(B) – молярные массы веществ A и B, а νA и νB – стехиометрические коэффициенты.
Уравнению реакции можно придать вид
A + (νB/νA)B → Продукты реакции ,
где νA>νB, что означает, что одна частица вещества A будет эквивалентна νB/νA частиц вещества B.
Отношение νB/νA обозначают символом fэ и называют фактором эквивалентности вещества B
fэ(B) = νB/νA..
Фактор эквивалентности является безразмерной величиной, равной или меньшей единицы.
Величину νB/νAB или равную ей fэ(B)B называют эквивалентом вещества B.
Во избежание противоречий необходимо приводить реакции к единой общей основе. Для реакций кислотно-основного взаимодействия такой основой может быть ион водорода.
В окислительно-восстановительных реакциях количество реагирующего вещества удобно связывать с числом электронов, принимаемых или отдаваемых данным веществом. Это позволяет дать следующее определение.
Эквивалентом называется реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
При использовании термина "эквивалент" всегда необходимо указывать, к какой конкретной реакции он относится.
Под условной частицей понимаются как реально существующие частицы (молекулы, ионы, электроны и т.д.), так и доли таких частиц (например,1/2 иона) или их группы.
Единицей количества вещества эквивалента является моль. Например, в реакции
NaOH + 1/2 H2SO4 → 1/2 Na2SO4 + H2O
fэ(NaOH)=1; fэ(H2SO4)=1/2
Эквивалент серной кислоты в этой реакции будет составлять половину молекулы (условная частица)
fэ(H2SO4) H2SO4 = 1/2 H2SO4
Для реакции
H3PO4 + KOH → KH2PO4 + H2O
fэ(H3PO4)=1; fэ(H3PO4) H3PO4 = H3PO4 ,
а для реакции
H3PO4 + 3 KOH → K3PO4 + 3H2O
fэ(H3PO4)=1/3; fэ(H3PO4) H3PO4 = 1/3 H3PO4.
В полуреакции
MnO4- + 8H+ + 5e → Mn2+ + 4 H2O
fэ(KMnO4)=1/5; fэ(KMnO4) KMnO4 = 1/5 KMnO4 ,
но в полуреакции
MnO4- + 4H+ + 3e → MnO2 + 2H2O
fэ(KMnO4)=1/3; fэ(KMnO4) KMnO4 = 1/3 KMnO4.
Фактор эквивалентности и эквивалент данного вещества являются не постоянными величинами, а зависят от стехиометрии реакции, в которой они принимают участие. Таким образом,
Фактор эквивалентности – это число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в реакции окисления-восстановления.
Молярной массой эквивалента (Mэ) вещества X называют массу одного моля эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества X. Для молярной массы эквивалента в литературе встречается также термин "эквивалентная масса".
Молярный объем - объем, занимаемый молярной массой газообразного вещества. Молярный объем любого газа при нормальных условиях равен 22,4 л.
Эквивалентный объем - объем, занимаемый молярной массой эквивалента газообразного вещества. 1 моль водорода содержит 2 эквивалента. Объем молярной массы эквивалента водорода (1 г/моль) - 22,4/2 = 11,2 л. 1 моль кислорода содержит 4 эквивалента. Объем молярной массы эквивалента кислорода (8г/моль) 22,4/4 = 5,6 л.
Концентрации растворов выражают множеством способов. Молярность или молярная концентрация – самая распространенная единица измерения концентрации. По определению одномолярным раствором называется такой раствор, в одном литре которого содержится один моль вещества. В более общем случае молярностью раствора называется его концентрация, выраженная в виде количества молей в литре (моль/л).
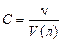
Вместо обозначения моль/л часто используют М, например, одномолярный раствор можно записать 1 моль/л или 1 М. В экспериментах часто имеют дело с достаточно малыми количествами вещества, для которых удобнее использовать единицы измерения миллимоль, милиграмм, милилитр. Обратите внимание, что единица г/моль – это то же самое, что мг/ммоль; г/л – то же самое, что мг/мл; а моль/л – то же самое, что ммоль/мл.
Для многих достаточно концентрированных коммерческих растворов кислот и щелочей в качестве концентрации указывается массовая доля растворенного вещества (в процентах). Она рассчитывается, как известно, следующим образом.
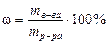
Часто возникает необходимость приготовить из концентрированных препаратов, растворы заданной молярности. Если дана молярная концентрация исходного раствора, то найти молярную концентрацию раствора, полученного его разбавлением очень легко. При разбавлении вещества его количество не изменяется, лишь увеличивается объем раствора и уменьшается концентрация.
ν = C·V
Отсюда следует, что произведение молярной концентрации раствора на его объем есть величина постоянная.
C1·V1 = C2·V2
где C1и C2·– молярные концентрации исходного и конечного растворов; V1и·V2 – объемы исходного и конечного растворов.
В случае использования исходных растворов, для которых указана массовая доля, вычисления проводятся следующим способом.
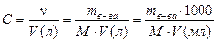
Объем раствора связан с массой раствора простым соотношением:
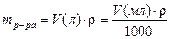
Объединяя формулы получаем:
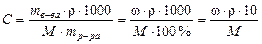
Чтобы выполнить соответствующие расчеты, необходимо знать плотность исходного раствора. Напомним, что плотностью называется масса единицы объема вещества при заданной температуре (обычно 20 °С), выражаемая, как правило, в г/мл (г/см3).
Иногда для вещества указывают не плотность, а удельный вес. Удельный вес – это отношение массы физического тела (например, раствора), находящегося при 20 °С, к массе равного объема воды, находящегося при 4 °С (иногда 20 °С). Таким образом, удельный вес – это отношение плотностей двух веществ, т.е. величина безразмерная. Поскольку плотность воды при 4 °С составляет 1,00000 г/мл, то плотность вещества равна его удельному весу, отнесенному к воде при 4 °С. Т.е. при проведении вычислений значение удельного веса можно использовать вместо плотности.
Эквивалентность (нормальность) N показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Моляльность CM показывает количество растворенного вещества, содержащегося в 1000 г раствора.
Молярная доля ωМ показывает долю в молях растворенного вещества по отношению к сумме молей всех компонентов, находящихся в растворе.
Титром Т называется число грамм растворенного ещества, содержащихся в 1 см3 (мл) раствора.
Пример 1. Определить, какая среда - кислая, щелочная или нейтральная - получится при смешивании 8 г NaOH с 10 г H2SО4.
Решение.
Формула для расчета: m1/Э1 = m2/Э2 применительно к задаче записывается так: m(NaOH)/Э(NaOH) = m(H2SO4)/Э(H2SO4).
Подставим числовые значения Э(NaOH) = 40;
Э(H2SO4) = 49, получим: 8/40 < 10/49.
Учитывая, что
m(NaOH) / Э(NaOH) = nЭ(NaOH); m(H2SO4)/ Э (H2SO4)= nЭ(H2SO4),
делаем вывод: среда кислая, так как для реакции взято избыточное количество эквивалентов кислоты:
nЭ(NaOH) < nЭ(H2SO4).
Пример 2. Найти молярную концентрацию раствора H2SO4, полученного разбавлением 5 мл раствора с концентрацией 1 моль/л в колбе на 1 л.
Решение:
C1·V1 = C2·V2
Выражаем концентрацию конечного раствора и подставляем данные:
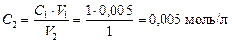
Переводить литры в миллилитры всегда не обязательно, так как размерности все равно сокращаются, но главное сохранять единую размерность.
Пример 3. Найти молярную концентрацию 15%-ного раствора H2SO4 (ρ = 1,10 г/мл).
Решение:
Для вычисления молярной концентрации используем выведенную выше формулу:
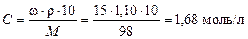
Пример 4.Вычислите: а) процентную ω; б)молярную C; в) моляльную CM; г) эквивалентную N концентрацию раствора Н3РО4, соержащего 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/ см3. Чему равен титр этого раствора?
Решение.1) масса воды = 282 ·1 = 282 г/ см3; 2) масса раствора = 18 + 282 = 300 г; 3) объем раствора = 300: 1,031=291 см3; 4) молярность раствора = (18/98): 0,291 =0,63 моль/л; 6)моляльность раствора= [(18/98):282]·1000 = 0,65 моль/ 1000г Н2О; 7) эквивалентность N раствора =[(18/98:3)] : 0,291=1,89 моль/л; 8) титр раствора = 18/291 = 0,06 г/ см3.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
111. Сколько эквивалентов заключается в 1 моле СНзСООН, NH4OH, Na2O, А1(ОН)3, A12(SO4)3, Н2, FeCl3, Н2O?
112. Какова молярность молярной концентрации эквивалента раствора FeCl3 с 3 моль/л (3 н)?
113. При взаимодействии кислорода и фосфора израсходовано 2,8 л кислорода (нормальные условия). Сколько эквивалентов Р2O5 получилось?
114. Из 0,635 г оксида металла получено 0,4135 г металла. Определите молярную эквивалентную массу металла и оксида.
115. Для нейтрализации некоторого объема H2SO4 израсходовано 24,2 мл раствора молярной концентрации эквивалента щелочи - 0,1 моль/л. Вычислите, сколько H2SO4 было в растворе?
116. Определите молярную концентрацию и концентрацию раствора (Сн) 30%-й НС1 с р = 1,15г/мл. Сколько этой кислоты потребуется для приготовления 100 мл раствора концентрации 1 моль/л (1 н)?
117. Сколько эквивалентов заключается в 1 моле О2, Р2О5, Na2CО3, НВг, Со(ОН)2, Са3(РО4)2?
118. Какова нормальность 1,5М раствора NiSO4?
119. Сколько граммов цинка и серной кислоты вступили в реакцию, если при этом выделилось 5,6 л водорода (н.у.)?
120. Сколько граммов щелочи NaOH потребуется для растворения 4 молей Zn(OH)2?
121. Сколько раствора КОН концентрации 0,5 моль/л (0,5 н) потребуется для полной нейтрализации раствора, содержащего 6,5 г H2SO4?
122. Определите молярность и нормальность 70%-й НС1O4 с р = 1,7 г/мл. Сколько этой кислоты потребуется для приготовления 200 мл раствора концентрации 4 моль/л (4 н)?
123. Сколько эквивалентов заключается в 1 моле N2, H2S, СO2, СаСO3, Сr2O3, Н3РO4?
124. Какова молярность раствора Н3РO4 концентрации 1,5 моль/л (или 1,5 н)?
125. Для полного окисления 2,25 г металла потребовалось 1400 мл кислорода (н.у.). Определите эквивалентную массу металла и оксида.
126. Смешали растворы, содержащие по 1 г НСl и КОН. Какая будет среда: кислая, щелочная или нейтральная?
127. Вычислите, сколько граммов Ва(ОН)2 потребуется для полной нейтрализации 100 мл раствора H2SO4 концентрации 1 моль/л (1 н).
128. Определите молярность и молярную концентрацию эквивалента (нормальность) 13,5%-й НС1 с р = 1,065 г/мл. Сколько этой кислоты потребуется для приготовления 250 мл раствора концентрации 0,5 моль/л (0,5 н)?
129. При сжигании 3,04 г металла было получено 5,04 г оксида. Определите атомную массу металла, зная, что его валентность равна двум, и составьте формулу оксида.
130. Какой объем раствора НС1 концентрации 0,4 моль/л (0,4 н) следует прибавить к раствору AgNO3 для получения 0,2867 г AgCl?
131. Определите титр Т, эквивалентность N, молярность C, моляльность раствора Cм
| Задача | растворенное вещество | ω, % | плотность ρ, г/ см3 |
| 131 а | KOH | 1,27 | |
| 131 б | H2SO4 | 1,04 | |
| 131в | HNO3 | 1,316 | |
| 131 г | NaOH | 1,109 | |
| 131 д | A1С13 | 1,09 | |
| 131 е | BaCl2 | 1,203 | |
| 131 ж | CuSO4 | 1,107 | |
| 131 з | HCl | 1,100 | |
| 131 и | KOH | 1,092 | |
| 131 к | H2SO4 | 1,105 | |
| 131л | H3PO4 | 1,254 | |
| 131 м | HgCl2 | 1,041 | |
| 131 н | AgNO3 | 1,194 | |
| 131 о | HClO4 | 1,128 |
132. Какой объем, мл, раствора Аисх Vисх потребуется для приготовления заданного объема Vзд раствора Взд заданной концентрации?
| Задача | Объем заданного раствора Vзд, мл | заданный раствор Взд | Исходный раствор Аисх | ||
| ρзд, г/ мм | С вщества | ρисх, г/ мм | С вщества | ||
| 133а | 1,0051 | 1% H2SO4 | 1,0385 | 6 % H2SO4 | |
| 133 б | 1,0051 | 0, 1 М H2SO4 | 1,0385 | 6 % H2SO4 | |
| 133 в | 1,0051 | 0, 1 М H2SO4 | 1,0250 | 4% H2SO4 | |
| 133 г | 1,0032 | 0, 1 N HCl | 1,0132 | 3% HCl | |
| 133 д | 1,0032 | 1% HCl | 1,0230 | 5% HCl | |
| 133 е | 1,0032 | 0, 4 N HCl | 1,0230 | 5% HCl |
