Способы выражения концентрации растворов
Концентрация раствора определяет отношение количества (моль) или массы (г) данного компонента в растворе к массе или объему раствора либо растворителя.
В химической практике используются различные виды выражения концентрации растворов:
1. Массовая доля или процентная концентрация вещества В, ω (B) – отношение массы данного компонента m (B) к массе всего раствора mр-ра:
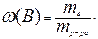
Массовая доля выражается в долях единицы или процентах1. Масса раствора складывается из массы растворителя и массы растворенных веществ (одного или нескольких).
2. Молярная доля или мольная доля вещества B, N(B) - отношение количества вещества данного компонента - nB, содержащегося в растворе, к общему количеству всех компонентов раствора ( 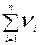 ):
):
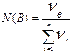 .
.
Выражается в долях единицы или процентах1.
В простейшем случае для системы растворитель – одно растворенное вещество: n1 – количество вещества растворителя, моль; n2 – количество растворенного вещества, моль. Тогда
N1 = n1/(n1 + n2) – мольная доля растворителя;
N2 = n2/(n1 + n2) – мольная доля растворенного вещества.
Сумма мольных долей N1+N2=1; всегда 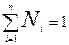 .
.
3. Молярная концентрация вещества B или молярность, С(B) – отношение количества данного компонента – νB, содержащегося в растворе, к объёму раствора Vр-ра:
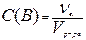 .
.
Выражается в моль/л и обозначается буквой М. Например, С(NaCl) = 0,1 моль/л = 0,1М.
4. Молярная концентрация эквивалента вещества B или нормальная концентрация, Сэ(B) – отношение количества эквивалента данного компонента– νэ B, содержащегося в растворе, к объёму раствора Vр-ра:
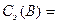
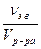 .
.
Выражается в моль/л или обозначается н. Например, Сэ(H2SO4) = 0,2 моль/л = 0,2н.
5. Моляльная концентрация вещества B или моляльность, Cт(B) - отношение количества вещества данного компонента - νB, содержащегося в растворе, к массе растворителя (в кг) mр-ля:
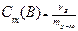 .
.
Выражается в моль/кг.
6. Титр раствора по веществу В, Т(В) – отношение массы данного компонента (в граммах) - mв, содержащегося в растворе, к объёму раствора (в мл или см3) – Vр-ра:
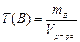 .
.
Выражается в г/мл или г/см3.
Растворимость
Способность одного вещества растворяться в другом при заданных условиях имеет количественное выражение, называемое растворимостью. Растворимость данного вещества равна его концентрации в насыщенном растворе при данной температуре. Часто растворимость дается как масса растворенного вещества в насыщенном растворе, приходящаяся на 100 г массы растворителя, или как молярная концентрация растворенного вещества в насыщенном растворе (в этом случае растворимость обозначается S, выражается в моль/л).
Насыщенным раствором называется такой раствор, который находится в динамическом равновесии с избытком растворяемого вещества. Понятие «насыщенный раствор» связано с обратимостью процесса растворения. На границе раздела фаз растворяемое вещество – раствор одновременно идут два процесса: растворение и выделение вещества из раствора (кристаллизация). Если скорости этих процессов равны, то система находится в состоянии динамического равновесия (Vр-ния=Vкрист), отвечающего насыщению раствора.
Если концентрация вещества в растворе при заданных условиях меньше его растворимости, то раствор является ненасыщенным. Скорость растворения при контакте вещества с растворителем больше скорости выделения вещества из раствора (Vр-ния>Vкрист).
При определенных условиях можно получить раствор, концентрация вещества в котором больше растворимости (осторожное и медленное охлаждение насыщенных при высокой температуре растворов). Такой раствор называют пересыщенным. Контакт раствора с веществом вызывает выделение вещества из раствора (Vр-ния<Vкрист). Концентрация пересыщенного раствора падает до тех пор, пока не становится равной растворимости вещества при данных условиях. Пересыщенные растворы весьма неустойчивы. Простое сотрясение сосуда или введение в раствор кристаллика соли вызывает выпадение в осадок избытка растворенного вещества.
Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым. Если растворяется менее 1 г вещества – малорастворимым, и наконец, - практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Однако абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или проволочку из золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как известно, растворы серебра или золота в воде убивают микробов. Стекло, серебро, золото - практически нерастворимые в воде вещества.
Растворимость зависит от:
- природы растворенного вещества и растворителя;
- внешних условий (температуры; давления для газообразных веществ).
Влияние на растворимость природы компонентов.При получении растворов часто выполняется эмпирическое правило: подобное растворяется в подобном (полярное – в полярном, неполярное – в неполярном). Т.е. полярные и ионные вещества хорошо растворимы в полярных растворителях (например, поваренная соль NaCl, в которой реализуется ионная связь хорошо растворяется в воде, молекулы которой полярны). Неполярные вещества хорошо растворимы в неполярных растворителях (пример: керосин растворяется в растительном масле).
Влияние на растворимость внешних условий. Поскольку растворимость характеризует истинное равновесие, для определения влияния температуры и давления на растворимость можно воспользоваться принципом Ле Шателье: характер действия Т и Р будет определятся соответственно знаком DHр и DVр, а его величина – их абсолютным значением.
Чаще всего растворимость твердых веществ при повышении температуры увеличивается (DHр>0), а жидких и газообразных – уменьшается (DHр<0).
Так как при растворении газообразных веществ в жидкости DV<0, то повышение давления, согласно принципу Ле Шателье, способствует росту растворимости газов. Эта зависимость растворимости от давления для малорастворимых веществ (газов) выражается законом Генри: растворимость газа прямо пропорциональна его парциальному давлению над раствором ( 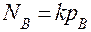 , где NВ - молярная (мольная) доля газа В в растворе; pВ - парциальное давление данного газа над раствором; k - константа Генри, справочная величина).
, где NВ - молярная (мольная) доля газа В в растворе; pВ - парциальное давление данного газа над раствором; k - константа Генри, справочная величина).
Природа жидких растворов
Химическая и физическая теории растворов. Химические явления в процессе растворения были отмечены Д.М. Менделеевым: при растворении веществ выделялась или поглощалась теплота (DН¹0), были известны кристаллогидраты (вещества, в кристаллы которых входят молекулы воды), которые выделялись из растворов. Например: CuSO4·5H2O, Na2SO4·H2O, FeSO4·7H2O, Na2CO3·10H2O.
Суть химической теории Менделеева (1887г.) состоит в том, что при растворении многих веществ в воде их молекулы (или ионы) связываются с молекулами растворителя, образуя соединения (комплексы), называемые сольватами (от латинского solvere – растворять); этот процесс химического взаимодействия молекул (частиц) растворителя с частицами растворенного вещества называют сольватацией (в общем случае). В частном случае, если растворитель – вода, процесс называется гидратацией, а продукты взаимодействия – гидратами. Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов (кристаллогидраты).
Химическая теория растворов принципиально отличается от физической теории, которая рассматривала растворитель как инертную среду и приравнивала растворы к простым механическим смесям. Физическая теория растворов развивалась главным образом трудами Вант-Гоффа, Рауля, Аррениуса.
Двойственная природа жидких растворов. Растворение – физико-химический процесс.Современная теория растворов является синтезом химической (Менделеев) и физической (Вант-Гофф, Рауль, Аррениус) теории. В создании современной физико-химической теории растворов большую роль сыграли работы русских ученых И.А. Каблукова (изучал неводные растворы), Д.П. Коновалова, Н.А. Измайлова, К.П. Мищенко, О.Я. Самойлова и др.
Растворение веществ сопровождается тепловым эффектом: или выделением, или поглощением теплоты – в зависимости от природы вещества. При растворении разрушается связь между молекулами (атомами, ионами) в растворяемом веществе и растворителе, что связано с затратой энергии(DH1>0). Одновременно протекает процесс возникновения новых связей между частицами вещества и растворителя (сольватация), он сопровождается выделением энергии (DH2<0). Общий же энергетический эффект растворения DHр=DH1+DH2 может быть как экзотермическим, так и эндотермическим в зависимости от соотношения количеств выделяемой и поглощаемой энергии. Например, растворение H2SO4 в Н2О экзотермический процесс (DH<0). При растворении в воде твердых веществ теплота может и выделяться – растворение КОН, Са(ОН)2 – и поглощаться – растворение NH4NO3. Поэтому нагревание по-разному сказывается на их растворимости. Если растворение вещества сопровождается выделением теплоты, то при нагревании его растворимость падает (КОН). Если же вещества растворяются с поглощением теплоты, то нагревание вызывает увеличение растворимости (NH4NO3).
Кроме энергетического эффекта растворение сопровождается также изменением объема. Например, при растворении спирта в воде объем раствора уменьшается примерно на 3,5% по сравнению с общим объемом взятых веществ за счет образования сольватов.
При растворении иногда наблюдается и изменение окраски. Например, белый сульфат меди CuSO4 образует водный раствор синего цвета за счет возникновения гидратированных аквакомплексов [Сu(Н2О)6]2+
Все эти факты (энергетический эффект растворения DHр=DH1+DH2,изменение объема и окраски при растворении) говорят о том, что жидкие растворы следует рассматривать как химические соединения. Однако отсутствие у растворов постоянного состава, т.е. определенных соотношений количества растворенного вещества и количества растворителя, сближает их с механическими смесями. Таким образом, жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями.
Образование растворов может рассматриваться с двух сторон: физической и химической, и в растворах виднее, чем где-либо, насколько эти стороны естествознания сближены между собой.
Типы и свойства растворов
Типы растворов.По количеству растворенного вещества растворы могут быть разбавленными (в одном литре разбавленного раствора содержится менее одного моля растворенного вещества) и концентрированными.
По количеству растворенного вещества и характеру установившегося равновесия между растворенным веществом и растворителем растворы делятся на ненасыщенные , насыщенные и пересыщенные (раздел 8.4).
По результату взаимодействия вещества с растворителем растворы делят на ионные (в них растворяемое вещество частично или полностью диссоциировано на ионы) и молекулярные (растворяемое вещество распределяется в растворителе в виде отдельных молекул).
По электрической проводимости растворы делятся на:
- растворы неэлектролитов, не способные проводить электрический ток (молекулярные растворы);
- растворы электролитов, проводящие электрический ток (ионные растворы, проводники второго рода).
Растворенные вещества делятся, в свою очередь, на неэлектролиты и электролиты.
Неэлектролиты – это вещества, которые в растворе и расплаве не диссоциируют (не распадаются) на ионы.
Электролиты – это вещества, которые в расплавах, воде и других полярных растворителях диссоциируют на ионы.
Общие свойства жидких растворов.Все растворы обладают рядом общих свойств:
1. Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем; при этом, чем больше концентрация растворенного вещества, тем давление ниже (это свойство описывает I закон Рауля).
Насыщенный пар – это пар, находящийся в равновесии с жидкостью; Vисп=Vконд.
2. Растворы всегда кипят при температурах более высоких, а замерзают при более низких, чем чистый растворитель (это свойство описывает II закон Рауля).
3. Для растворов характерно явление осмоса (это свойство описывает закон Вант-Гоффа).
Эти свойства количественно зависят от числа частиц растворенного вещества, от концентрации раствора и от того, является ли данный раствор раствором электролита или неэлектролита.
Для количественного описания свойств растворов используют модель идеального раствора. Если при образовании раствора тепловой эффект ∆Н=0, изменение объема ∆V=0, изменение энтропии ∆S = ∆S идеального раствора, то раствор называют идеальным. В идеальном растворе между компонентами нет химического взаимодействия; каждый компонент ведет себя в идеальном растворе независимо от остальных компонентов, и свойства раствора при данных условиях определяются только концентрацией растворенного вещества. Из реальных растворов лишь разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
Примерами растворов неэлектролитов могут служить, например, растворы кислорода и сахара в воде, водные растворы органических спиртов, растворы углеводородов в углеводородах и т.д.
