Способы выражения концентрации растворов
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M".
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
9. Электролитическая диссоциация. Слабые и сильные электролиты. Кислоты, основания, соли как электролиты?
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью. Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами.
Кислоты, основания, соли как электролиты
Кислоты - это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют.
H2SO4 =2H++SO42−,
HF 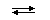 H+ + F−
H+ + F−
Соли - это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н+ и любые анионы, кроме OH−
· CuSO4 = Cu2+ + SO42−
· BaCl2 = Ba2+ + 2Cl−
· KHCO3 = K+ + HCO3−
· NaHS = Na+ + HS−
· KAl(SO4)2 = K+ + Al3+ + 2SO42−
Основания - это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют:
KOH=K++OH−,
Ca(OH)2 = Ca2+ + 2OH−
10. Окислительно-восстановительные реакции. Окислители и восстановители. Классификация ОВР. Методы электронного баланса.
Окислительно-восстановительные реакции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Окисление — процесс отдачи электронов, с увеличением степени окисления. Восстановление - процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
Классификация ОВР
1) реакции межмолекулярного окисления-восстановления─реакции, в которых окислитель и восстановитель ─ разные вещества.
2MgO0+O20=2Mg2+O2-
4N3-H3+3O2-=2N20+6H2O2-
2) реакции диспропорционирования (реакции самоокисления-
самовосстановления) ─ реакции, в которых происходит одновременное
увеличение и уменьшение степени окисления атомов одного и того же
элемента. Эти реакции возможны для веществ, содержащих атомы с промежуточной степенью окисления:
4KCl5+O3=3KCl7+O4+KCl+1
3) реакции внутримолекулярного окисления-восстановления ─ реакции, которые протекают с изменением степеней окисления атомов одного и того же соединения:
2KCl5+O32-=2KCl1-+3O20
4) реакции компропорционирования─реакции,в которых участвуют два вещества, содержащие атомы одного и того же элемента в разных степенях окисления. В результате получается вещество, содержащее атомы того же элемента в промежуточной степени окисления:
Cu0+Cu2+Cl2=2Cu1+Cl
Суть метода электронного баланса заключается в:
- В подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
- Элементы, степень окисления которых в результате произошедшей реакции не изменяется - не принимаются во внимание
- Из остальных элементов, степень окисления которых изменилась - составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
- Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
- Найденное значение и есть базовые коэффициенты для составления уравнения.
11. Скорость химических реакций. Обратимые и необратимые реакции. Химическое равновесие и способы его смещения?
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Обратимая химическая реакция - Это химическая реакция которая может проходить как в одном так и в другом направлении.
Способы смещения химического равновесия
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
N2 + 3H2  2NH3 + Q 2NH3 + Q |
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
| При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции. |
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:
| При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом |
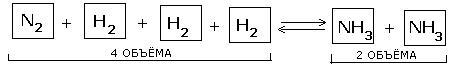
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
| При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. |
12. Металлы. Положение в таблице Менделеева. Особенности строения, свойства, способы получения металлов?
Металлы, особенности строения - наличие плотной кристаллической структуры; - выраженный блеск; - способность к электрической проводимости; - высокая степень теплопроводности; - снижение способности проводить электричество с увеличением теплового режима; - легкая отдача электронов; - тягучесть, а также ковкость; - способность образовывать различные сплавы.
