Фотоколориметрическое определение Cr (VI) в сточных водах
Лабораторная работа №
Общие положения
Фотометрический метод количественного анализа основан на способности определяемого вещества, компонента смеси или их окрашенных аналитических форм поглощать электромагнитное излучение оптического диапазона. Концентрацию поглощающего вещества определяют, измеряя поглощение. Поглощение при определенной длине волны является, таким образом, материальным воплощением информации о качестве и количестве определяемого вещества и составляет аналитический сигнал.
В фотометрическом анализе используют поглощение электромагнитного излучения в УФ-, видимой и ИК-областях спектра. Наибольшее распространение получили фотометрические методы анализа, основанные на поглощении в видимой области спектра, т. е. в интервале длин волн 400–780 нм. Это объясняется возможностью получения множества интенсивно окрашенных органических и неорганических соединений, пригодных для их фотометрического определения в видимой области спектра с помощью достаточно несложных и относительно недорогих приборов.
Химические реакции, используемые в фотометрическом анализе, несмотря на различие в их химизме, должны обязательно сопровождаться возникновением, изменением или ослаблением светопоглощения раствора. Как и каждая реакция, используемая в количественном анализе, цветная реакция должна протекать избирательно, быстро, полностью и воспроизводимо. Кроме того, окраска образующейся аналитической формы должна быть устойчивой во времени и к действию света, а поглощение раствора, несущее информацию о концентрации поглощающего вещества, должно подчиняться физическим законам, связывающим поглощение и концентрацию, конкретно – закону Бугера-Ламберта-Бера.
В неорганическом фотометрическом анализе наиболее часто используют реакции комплексообразования ионов определяемых элементов с неорганическими и особенно с органическими реагентами, реже – реакции окисления-восстановления, синтеза и других типов. В органическом фотометрическом анализе чаще применяют реакции синтеза окрашенных соединений, которыми могут быть азосоединения, полиметиновые и хинониминовые красители, ациформы нитросоединений и др. Иногда используют собственную окраску веществ.
Общая схема выполнения фотометрического определения едина и включает следующие стадии.
1. Подготовка пробы и переведение определяемого вещества или компонента в раствор, конкретно в реакционноспособную, в зависимости от химизма аналитической реакции, форму.
2. Получение окрашенной аналитической формы определяемого вещества в результате проведения цветной реакции при оптимальных условиях, обеспечивающих ее избирательность и чувствительность.
3. Измерение светопоглощения раствора аналитической формы, т. е. регистрация аналитического сигнала при определенных условиях, отвечающих его локализации и наибольшей интенсивности.
4. Проверка результата анализа, оценка его воспроизводимости и выдача окончательного результата с метрологической оценкой.
Для осмысленного выполнения практических задач необходимо вспомнить некоторые важнейшие вопросы теории метода.
Электронные переходы и спектры поглощения. Поглощение квантов электромагнитного излучения оптического диапазона молекулой или ионом обусловлено переходами электронов между электронными уровнями из основного в возбужденное состояние. Через 10-9 с частица, поглотившая квант, переходит обратно в основное состояние и вновь оказывается способной поглощать фотоны. Энергия, выделяющаяся при этом переходе, рассеивается в окружающей среде в виде тепла.
Молекулы некоторых веществ могут терять энергию поглощенных квантов в виде фотонов, когда реализуется явление фотолюминесценции.
Каждому электронному состоянию соответствует набор колебательных подуровней, поэтому в спектре поглощения наблюдается система полос поглощения, соответствующих электронным переходам между подуровнями основного и возбужденного состояний.
В фотометрическом анализе поглощающее вещество обычно находится в растворе, поэтому межмолекулярное взаимодействие поглощающего вещества и растворителя значительно увеличивает ширину полосы поглощения. Для каждого поглощающего вещества имеется определенное распределение интенсивности поглощения по длинам волн. При этом на кривой поглощения, называемой спектром, имеется один или несколько максимумов.
Одним из условий возможности поглощения молекулой данного кванта является отличие от нуля момента перехода R01, или, по крайней мере, одного из его компонентов (R01х, R01у, R01z). При этом вероятность поглощения и связанная с ней интенсивность поглощения пропорциональны величине R012. В многоатомных молекулах разрешены переходы между электронными уровнями, соответствующими электронным состояниям с различной симметрией распределения заряда, и переходы без изменения суммарного спина системы (синглет-синглетные переходы). Им в спектре чаще всего соответствуют полосы интенсивного поглощения. В отличие от них электронные переходы с изменением спина (например, синглет-триплетные) запрещены.
В фотометрическом анализе за поглощение аналитических форм ответственны именно переходы без изменения спина. Теоретическое рассмотрение спектров поглощения сложно и не всегда осуществимо, поэтому при химико-аналитическом использования электронных спектров, как правило, исходят из эмпирически полученного материала.
Цветность как способность к поглощению определенных квантов электромагнитного излучения оптического диапазона определяется электронным строением молекулы. Обычно ее связывают с наличием в молекуле так называемых хромофорных групп, к которым относят группировки атомов, обусловливающие поглощение электромагнитного излучения веществом в видимой и УФ-областях спектра. Конкретные хромофорные группы обусловливают возможность осуществления определенных электронных переходов.
За формирование аналитического сигнала ответственными являются d–d* электронные переходы, переходы с переносом заряда d–p*, p–d* и p-p*-переходы. d–d*-переходы характерны для аква-ионов и некоторых комплексов соединений d-элементов с неполностью заполненными d-орбиталями, когда возможность осуществления переходов возникает вследствие нарушения симметрии распределения электронной плотности и расщепления основного электронного состояния иона металла в поле лиганда. Переходы с переносом заряда возможны при наличии в молекуле или сложном ионе доноров и акцепторов электронов, когда имеет место электронный переход с орбитали, локализованной на атоме акцептора, на орбитали, локализованные на атоме донора или, реже, наоборот. Это, например, объясняет интенсивную окраску тиоцианата железа (III), гетерополисоединений, сложных ионов типа МnО4–, СrО4–, комплексов d-элементов с бесцветными органическими реагентами, например, никеля с диметилглиоксимом, железа с 1,10-фенантролином и молекул органических соединений, когда в них одновременно входят электронодонорные и электроноакцепторные заместители.
p-p*-переходы свойственны молекулам органических соединений с сопряженными С–С-связями, когда ввиду делокализации – обобществления – p-электронов энергия их возбуждения снижается и становится равной энергии квантов электромагнитного излучения оптического диапазона. p-p*-переходы обусловливают окраску многих органических соединений, используемых в органическом фотометрическом анализе в качестве аналитических форм определяемых веществ, например, азосоединений, полиметиновых, хинониминовых, трифенилметановых и др. Если молекула органического соединения вследствие наличия комплексообразующих групп способна образовывать комплексы с ионами металлов, то происходящее при этом изменение энергии p-электронов и, следовательно, p-p*-перехода вызывает появление или изменение окраски комплекса по сравнению с исходным соединением при данном рН раствора за счет изменения их спектров. Такое органическое соединение называют органическим аналитическим реагентом, а группировку атомов, обеспечивающую взаимодействие этого реагента с ионами металлов – функционально-аналитической группой. Свойства таких комплексообразующих реагентов широко используют на практике. К их числу относят, например, такие широкораспространенные реагенты, как арсеназо III, эриохромовый черный Т, ксиленоловый оранжевый, дитизон и многие другие.
Использование наиболее интенсивных полос поглощения в спектре аналитической формы обеспечивает наименьший предел обнаружения. Интенсивность поглощения может быть охарактеризована интегральным молярным коэффициентом поглощения e или определяемым экспериментально средним молярным коэффициентом поглощения e и коэффициентом поглощения в максимуме полосы поглощения elмакс или при данной длине волны el.
Основной закон поглощения. При прохождении потока излучения через частично поглощающую среду интенсивность прошедшего потока I согласно закону Бугера-Ламберта-Бера равна
I=I0*10–ellc
где I0– интенсивность падающего потока; el – молярный коэффициент поглощения при данной длине волны; I – толщина поглощающего слоя; с – концентрация поглощающего вещества, моль/л
или в логарифмической форме:
lgI= lgI0–el1с lg(I0/I) = A =ellc.
Величину lg(I0/I),характеризующую поглощательную способность вещества в растворе, называют оптической плотностью. В аналитической практике, стремясь подчеркнуть сущность процесса, лежащего в основе фотометрического определения, а именно поглощение квантов электромагнитного излучения оптического диапазона аналитической формой, эту величину называют поглощением или светопоглощением и обозначают буквой А. Для раствора поглощающего вещества при постоянных концентрации и толщине поглощающего слоя А зависит от длины волны.
Серию аналитических определений выполняют при постоянной толщине поглощающего слоя.
Значение поглощения А может быть считано непосредственно со шкалы прибора. Однако некоторые приборы имеют только шкалу пропускания Т (%):
Т=(I/I0)·100
Поэтому показания таких приборов при выполнении фотометрических определений необходимо пересчитывать на поглощение по формуле:
A= lg(1/T)·100= 2– lgT
На практике зависимость А от концентрации определяемого вещества при постоянной l и конкретных условиях аналитического определения изображают в виде градуировочного графика.
При этом молярный коэффициент поглощения, определяющий предел обнаружения метода, будет равен тангенсу угла наклона градуировочной прямой к оси абсцисс, если концентрация выражена в моль/л. Если концентрация выражена в массовых единицах, тогда угловой коэффициент составит коэффициент поглощения k. Чем больше наклон градуировочного графика к оси концентраций, тем более чувствительным является данный фотометрический метод.
Теоретическое значение молярного коэффициента поглощения составляет el=n·105. Для наиболее интенсивно окрашенных соединений эта величина обычно составляет n·104 и даже (1–2)·105. Тогда, пользуясь уравнением закона Бугера-Ламберта-Бера, можно определить нижнюю границу диапазона определяемых содержаний вещества смин по формуле:
смин=Aмин/ell,
полагая l =1 см и Aмин = 0,005, получим смин = 0,005/(104·1) = 5·10-7 моль/л. Если необходимо еще более понизить предел обнаружения, можно увеличить толщину поглощающего слоя или сконцентрировать вещество, например путем экстракции.
Закон Бугера-Ламберта-Бера строго справедлив лишь для разбавленных растворов при определенных условиях. Применительно к аналитическим целям условия таковы:
· постоянство состава и неизменность поглощающих частиц в растворе;
определяемые химизмом выбранной аналитической реакции и условиями ее проведения;
· монохроматичность проходящего через пробу лучистого потока;
· ограниченная интенсивность и параллельность лучистого потока, определяемые в основном конструктивными особенностями фотометрического прибора, в частности, способом монохроматизации излучения;
· постоянство температуры.
Если раствор аналитической формы не подчиняется закону Бугера – Ламберта – Бера, то это приводит к появлению систематических погрешностей при определении концентрации вещества в растворе по прямолинейному градуировочному графику. Следует отметить, что при устойчиво воспроизводимой нелинейности градуировочного графика также возможно получение достаточно точных результатов анализа. Однако подчинение раствора аналитической формы закону Бугера – Ламберта – Бера в общем случае все же остается основным условием его использования в фотометрическом анализе.
Причинами несоблюдения закона Бугера – Ламберта – Бера могут быть химические и инструментальные факторы. Химические причины обусловлены участием поглощающего вещества в реакциях, конкурирующих с аналитической. Схема, приведенная на рис. 1, для гипотетического случая определения иона металла М с реагентом HnR дает общее представление о важнейших из этих побочных реакций.
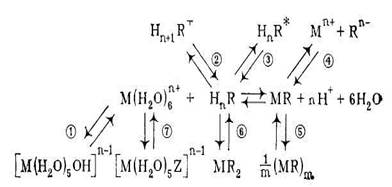
Рис. 1. Возможные химические причины отклонения от закона Бугера – Ламберта – Бера при фотометрическом определении иона металла Мn+ с органическим реагентом HnR:
1 – гидролиз иона металла; 2 – протонирование реагента; 3 – таутометрия реагента; 4 – ионизация комплекса; 5 – полимеризация комплекса; 6 – образование комплекса другого состава; 7 – конкурирующее комплексообразование иона металла с посторонним лигандом.
Следовательно, исключительно важное значение имеет обеспечение протекания основной аналитической реакции и подавление побочных, что возможно только при знании химизма осуществляемой аналитической реакции с целью управления им в желательном направлении.
При определении ионов металлов с использованием некоторых комплексообразующих реагентов можно найти оптимальные условия реакции и расчетным путем. Как правило, рекомендуемые условия фотометрического определения оптимизированы, и поэтому при выполнении определений необходимо строго соблюдать изложенный в методике способ работы.
Инструментальные факторы, обусловливающие отклонения от закона Бугера – Ламберта – Бера, связаны с недостаточной монохроматичностью лучистого потока и проявляются чаще всего при работе на фотоэлектроколориметрах. Это объясняется тем, что «монохроматизация» в этих приборах достигается с помощью светофильтров, пропускающих излучение в определенных интервалах длин волн. При работе с обычными светофильтрами, пропускающими излучение в достаточно широком интервале длин волн, результатом измерения является интегральное поглощение. По мере увеличения концентрации поглощающего вещества может измениться контур полосы поглощения или какого-то участка спектра. Поэтому поглощение, измеренное в интервале длин волн, соответствующем этому участку, будет возрастать не вполне симбатно увеличению концентрации. При этом прямо пропорциональная зависимость между интегральным поглощением и концентрацией поглощающего вещества нарушается. Это явление наблюдается чаще всего для растворов желтого цвета и при работе на приборах старых моделей. При использовании светофильтров с меньшей полосой пропускания, например интерференционных, а также при работе на более совершенных приборах – спектрофотометрах этот эффект сильно уменьшается или устраняется вовсе.
Если в растворе имеется несколько окрашенных веществ, не взаимодействующих между собой, то каждое из них поглощает независимо от других. Поэтому суммарное поглощение при данной длине волны Аl будет равно сумме поглощений отдельных компонентов при той же длине волны:
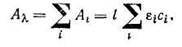
Принцип аддитивности может быть положен в основу анализа смесей окрашенных веществ. Так, измеряя поглощение смеси двух окрашенных веществ при двух различных длинах волн и зная их молярные коэффициенты поглощения при этих длинах волн, можно составить два уравнения с двумя неизвестными – концентрациями поглощающих веществ. Решение системы уравнений позволяет найти концентрации обоих веществ.
Условия фотометрического определения и их оптимизация. Фотометрическое определение выполняют при оптимальных условиях, обеспечивающих полноту образования аналитической формы в растворе и отсутствие или минимизацию отклонений от закона Бугера – Ламберта – Бера. Важнейшие из них:
· оптимальное значение рН раствора,
· достаточный избыток реагента,
· обеспеченная избирательность аналитической реакции,
· выбор наилучших условий измерения поглощения.
Для выбора оптимального значения рН при постоянных концентрациях определяемого вещества и реагента изучают влияние рН на интенсивность окраски раствора при определенной длине волны, ориентируясь на область наибольшего поглощения в случае бесцветного реагента. Для окрашенных растворов оптимум соответствует наибольшему различию в поглощении аналитической формы и исходных реагентов. Наиболее благоприятная ситуация складывается тогда, когда небольшие изменения рН практически не влияют на светопоглощение раствора при условии, что само поглощение по возможности максимально. С химической точки зрения влияние рН сказывается на ионном состоянии определяемого элемента или вещества и исходных реагентов, равновесии аналитической и побочной реакций, выходе и кинетической устойчивости аналитической формы. Постоянное значение рН в фотометрируемом растворе поддерживают соответствующими буферными растворами или достаточными количествами кислот или щелочей.
Аналитический реагент должен быть введен в количестве, достаточном для превращения всего определяемого вещества (в определенном интервале концентраций) в аналитическую форму. Из приведенной на рис. 2 схемы видно, что оптимальная концентрация реагента соответствует практически полному переведению определяемого вещества в аналитическую форму на верхней границе диапазона определяемых содержаний. Достаточность количества реагента проявляется в том, что дальнейшее прибавление реагента уже не изменяет выход продукта реакции и светопоглощения раствора.
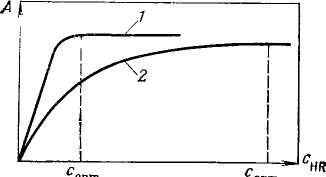
Рис 2. Выбор оптимальной концентрации реагента при фотометрическом определении: 1 – при образовании устойчивого комплекса, 2 – при образовании малоустойчивого комплекса
Фотометрируемый раствор должен оставаться истинным во всем диапазоне исследуемых концентраций. Если это условие не соблюдается, необходимо перейти в область более низких концентраций, или применять защитные коллоиды, препятствующие образованию твердой фазы, или изменить схему всего определения. Нерастворимые в воде аналитические формы довольно часто можно избирательно извлекать из водной фазы в органическую путем экстракции. Обычно объем экстракта меньше объема водной фазы, поэтому при экстракции осуществляется также еще и абсолютное концентрирование определяемого вещества, что позволяет снизить предел обнаружения.
В любом варианте фотометрического анализа поглощение аналитической формы определяют при оптимальной длине волны, если работают на спектрофотометре, или в оптимальном интервале длин волн, обеспечиваемом светофильтром при работе на фотоэлектроколориметре. При этом ориентируются на наибольшее различие в поглощении аналитической формы и исходных реагентов. Необходимо учитывать в их спектрах числа максимумов поглощения, их высоту, форму контура полосы поглощения (рис. 3), чувствительность фотометрического прибора в данной спектральной области.
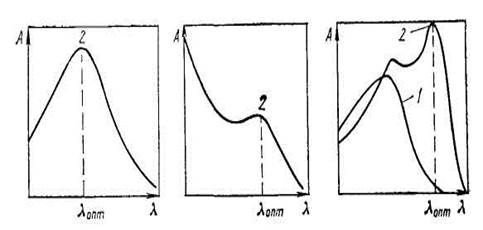
Рис.3. Принцип выбора оптимальной длины волны при фотометрическом определении: 1 – поглощение исходного реагента; 2 – поглощение аналитической формы
Разность между максимумами полос поглощения аналитической формы и исходного реагента в фотометрическом анализе называют контрастностью цветной реакции. Чем больше контрастность, тем удобнее данная реакция для фотометрии.
Поглощение раствора аналитической формы всегда измеряют относительно раствора сравнения, поглощение которого принимают за оптический нуль. Раствор сравнения содержит все исходные вещества за исключением определяемого.
На практике определяемому веществу или элементу всегда сопутствуют другие компоненты смеси, влияние которых на аналитическую реакцию может исказить результаты определения. Для обеспечения необходимой избирательности используют различие в физических и химических свойствах определяемых веществ, их аналитических форм, аналитических реакций определяемого и сопутствующих компонентов. Общие приемы достижения избирательности состоят:
· в получении характерной окраски аналитической формы, отличающейся от окраски побочных продуктов;
· в использовании маскирующих реагентов, связывающих ионы мешающих элементов в малодиссоциирующие комплексы;
· в проведении реакций, оптимальных только для определяемого компонента;
· в использовании различия растворимости аналитических форм определяемого и сопутствующего компонентов в воде и в органических растворителях и другие приемы.
В зависимости от характера решаемой практической задачи фотометрическое определение можно выполнить собственно фотометрическим или спектрофотометрическим методом, измеряя светопоглощение раствора на приборе с низкой или высокой степенью монохроматизации, т. е. на фотоэлектроколориметре или на спектрофотометре. Так как характеризующий чувствительность фотометрического определения молярный коэффициент поглощения в максимуме полосы поглощения elмакс, больше среднего e, то спектрофотометрический метод дает выигрыш в чувствительности и точности определения и позволяет поэтому определять меньшие количества вещества.
Погрешности фотометрического определения складываются из общих погрешностей, свойственных химико-аналитическим работам, и кроме того, из специфических погрешностей метода, возникающих вследствие неправильного проведения химической реакции, использования грязных кювет, невоспроизводимости установки кювет в фотометрическом приборе и неточной настройки его на оптический нуль, нестабильности работы используемого в приборе источника сплошного излучения и функционирования фотометрической схемы, а также за счет погрешностей при построении градуировочного графика. Естественно, что эти погрешности могут быть сведены к минимуму тщательной и аккуратной работой.
Объективные погрешности фотометрии вытекают из сущности законов поглощения. При отсутствии систематических погрешностей, т. е. при прохождении градуировочного графика через начало координат, относительная погрешность определения концентрации sc/c составляет:
sc/c = (sA/A) + (se/e) + (sl/l)
Значение e обычно велико, а отношение (se/e)мало, столь же мало значение (sl/l),поэтому наибольший вклад в суммарную погрешность определения концентрации вносит погрешность измерения поглощения, т. е. sc/c~sa/a.
Зависимость погрешности определения концентрации Dс/с от пропускания описывается выражением
Dс/с= dT/2,3T lgT
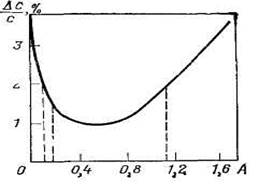
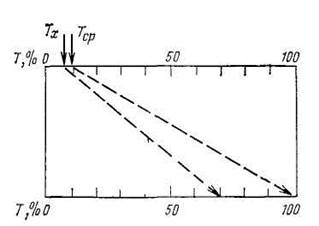
Рис 4. Зависимость погрешности определения концентрации от поглощения
Рис 5. Схема, объясняющая выигрыш в воспроизводимости в методе дифференциальной фотометрии
Поскольку A =2–lgT, то Dс/с является функцией А (рис. 4).
Из рис. 4 видно, что в области больших и малых поглощений погрешность измерения велика. Минимум функции (Dс/с) соответствует A = 0,435, т. е. Т = 36,6%. С погрешностью вдвое большей минимальной теоретической можно измерять поглощение в интервале 0,12–1,0, что позволяет определять концентрацию аналитической формы в растворе с воспроизводимостью не хуже 5% (отн.).
Дифференциальная фотометрия.Из рис. 4 следует, что при определении поглощения интенсивно окрашенных растворов аналитической формы с пропусканием <10% (A>1), соответствующих высокому содержанию определяемого вещества в растворе, погрешность определения концентрации будет недопустимо велика. Ее можно уменьшить, используя метод дифференциальной фотометрии. В отличие от обычной фотометрии поглощение исследуемого и стандартного растворов измеряют относительно раствора сравнения, содержащего точно известное количество определяемого вещества, переведенного в аналитическую форму. При этом концентрация поглощающего вещества в растворе сравнения близка к его концентрации в фотометрируемом растворе.
В дифференциальной фотометрии используют различные приемы работы. Чаще используют метод «определения больших концентраций». В соответствии с техникой дифференциальной фотометрии в этом методе оптический нуль фотометрического прибора по шкале поглощений (A = 0, T=100%) устанавливают по раствору сравнения, содержащему аналитическую форму определяемого вещества. Обычно таким раствором сравнения является один из растворов стандартного ряда. Тогда, выполняя измерение светопоглощения фотометрируемого раствора относительно этого стандартного раствора, может быть достигнуто расширение фотометрической шкалы и, следовательно, уменьшение погрешности измерения пропускания или поглощения. Как видно из рис. 5, эффект «расширения» фотометрической шкалы и дает улучшение воспроизводимости результата дифференциального фотометрического определения, который в этом методе характеризуется погрешностью 1% (отн.) по сравнению с 5% (отн.) в обычной фотометрии.
Так как соотношение поглощений растворов сравнения и фотометрируемого в дифференциальной фотометрии может быть и больше и меньше единицы, при работе удобно использовать метод двусторонней дифференциальной фотометрии: если A>Aср, используют прямой порядок измерения, если A<Aср – обратный порядок измерения, т. е. измеряют поглощение раствора сравнения относительно фотометрируемого и поглощение записывают со знаком минус. При этом градуировочный график не проходит через начало координат, но пересекает ось концентраций в точке, соответствующей концентрации определяемого вещества в растворе сравнения.
Результат определения может быть найден также и по формуле:
cx=AF + c0
Аналитический фактор F рассчитывают по формуле:
F =(сi+1– сi)/(Ai+1– Ai),
где Ai+1, Ai – поглощение каких-либо двух стандартных растворов с концентрациями определяемого вещества сi+1, сi.
Аппаратура.Регистрация аналитических сигналов в фотометрическом анализе осуществляется измерением светопоглощения раствора аналитической формы. Общий принцип измерения состоит в поочередном сравнении интенсивностей световых потоков, проходящих через раствор сравнения и фотометрируемый раствор. Поглощение анализируемого раствора измеряют относительно поглощения раствора сравнения (последнее принимают за оптический нуль). Интенсивности световых потоков измеряют только фотоэлектрическим способом – после преобразования излучения в электрический сигнал.
Приборы, применяемые для измерения поглощения растворов, можно классифицировать следующим образом.
1. По способу монохроматизации лучистого потока: приборы с призменным или решеточным монохроматором, позволяющие достигать высокой степени монохроматизации рабочего излучения, называют спектрофотометрами; приборы, в которых монохроматизация достигается с помощью светофильтров, называют фотоэлектроколориметрами.
2. По способу измерения: однолучевые с прямой схемой измерения (прямопоказывающие), двухлучевые с компенсационной схемой.
3. По способу регистрации измерений: регистрирующие инерегистрирующие.
Схема фотометрического однолучевого прибора приведена на рис. 6.
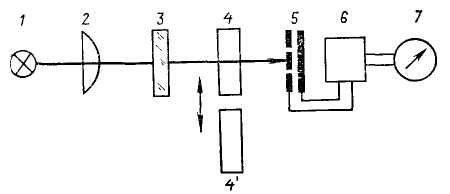
Рис. 6. Принципиальная схема фотометрического однолучевого прибора с прямым способом измерения:
1 – источник света; 2– линза; 3– светофильтр; 4, 4' – кюветы с растворами сравнения и фотометрируемым, соответственно; 5 – фотоэлемент; 6 – усилитель; 7 – показывающий прибор
Перед выполнением измерений в приборе устанавливают требующийся светофильтр 3. Затем проверяют настройку прибора на электрический нуль. В световой поток устанавливают кювету с раствором сравнения 4. При этом стрелка показывающего прибора 7 будет находиться в пределах шкалы. С помощью вспомогательной диафрагмы или, регулируя усиление фотопотока электронным усилителем 6, стрелку показывающего прибора устанавливают на отметку 100%-ного пропускания, соответствующего оптическому нулю в данной системе. Затем в световой пучок вместо кюветы с раствором сравнения 4 устанавливают кювету с фотометрируемым раствором 4'. В этом случае световой поток, прошедший через кювету с поглощающим веществом, уменьшается пропорционально его концентрации в соответствии с законом Бугера – Ламберта – Бера. Поэтому стрелка показывающего прибора 7 остановится на отметке, соответствующей пропусканию исследуемого раствора.
На шкалах таких приборов наряду с равномерной шкалой пропускания нанесена и логарифмическая шкала оптических плотностей (поглощения). При необходимости показания прибора по шкале пропускания пересчитывают на поглощение по вышеприведённой формуле.
Схема двухлучевого фотоэлектроколориметра приведена на рис. 7. Сначала прибор настраивают на электрический нуль согласно инструкции, и в оба световых потока вводят требующиеся светофильтры. Шкалу правого отсчетного барабана 6' устанавливают на нулевую отметку. Затем в левый световой лоток устанавливают кювету с раствором сравнения 5, а в правый с фотометрируемым 5'. Вследствие поглощения света фотометрируемым раствором интенсивность светового потока, падающего на правый фотоэлемент 7', будет меньше, – фотометрическое равновесие будет нарушено. При вращении левого компенсационного барабана 6 ширина щели в нем уменьшится и стрелка нуль-индикатора 9 в момент компенсации встанет на нуль. Затем в правый световой поток вводят кювету с раствором сравнения 5. При этом фотометрическое равновесие вновь нарушается, так как увеличивается световой поток, падающий на правый фотоэлемент 7'. Вращением рукоятки правого отсчетного барабана 6', уменьшающего ширину щели, фотометрическое равновесие будет вновь восстановлено, о чем можно будет судить по приведению стрелки нуль-индикатора 9 к нулю. Поглощение в этот момент считывают по шкале правого барабана 6'.
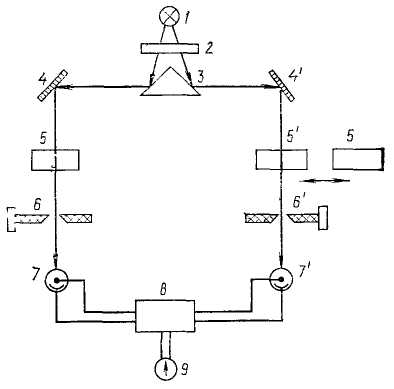
Рис. 7. Принципиальная схема фотометрического двухлучевого прибора с компенсационным способом измерения:
1 – источник света; 2 – светофильтр; 3 – линза; 4, 4' – зеркала; 5, 5' – кюветы с растворами сравнения и фотометрируемым, соответственно; 6, б' – щелевые диафрагмы; 7, 7' – фотоэлементы; 8 – усилитель; 9 – нуль-индикатор
Обобщенная схема однолучевого нерегистрирующего спектрофотометра приведена на рис. 8.
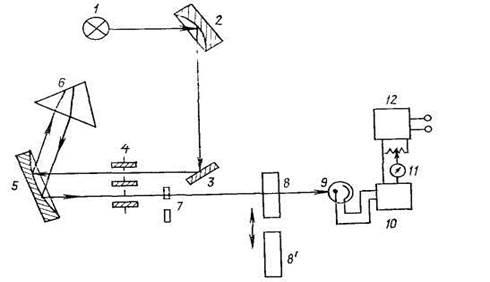
Рис 8. Принципиальная схема однолучевого спектрофотометра с компенсационным способом измерения:
1 – источник света; 2, 5 – сферические зеркала; 3 – плоское зеркало; 4 – входная и выходная щель; 6 – призма; 7 – корректирующие светофильтры; 8, 8'– кюветы с растворами сравнения и фотометрируемыми, соответственно; 9 – фотоэлемент; 10 – усилитель; 11 – нуль-индикатор; 12 – блок питания и источник компенсирующего напряжения
Сначала рукояткой барабана длин волн, связанной с призмой 6, устанавливают необходимую длину волны. Затем включают прибор и после его прогрева при закрытой шторке-переключателе и, следовательно, при неосвещенном фотоэлементе устанавливают электрический нуль прибора, компенсируя «темновой ток» усилителя 10 потенциометром темнового тока, выводят на нуль стрелку нуль-индикатора 11. Далее на пути монохроматического луча устанавливают кювету с раствором сравнения 8 и открывают шторку фотоэлемента 9. Возникающий в нем фототок усиливается и передается на нуль-индикатор 11, стрелка которого отклоняется от нуля. Изменением ширины щели 4 устанавливают оптический нуль прибора, приводя стрелку нуль-индикатора к нулю. Затем на пути монохроматического луча устанавливают кювету с фотометрируемым раствором 8'. Ввиду поглощения интенсивность светового потока, падающего на фотоэлемент 9, уменьшится, и стрелка нуль-индикатора 11 отклонится от нуля. Вращая рукоятку отсчетного потенциометра, возвращают стрелку в нулевое положение, при этом на вход усилителя подается э.д.с, равная фото-э.д.с, но противоположной полярности, т.е. измеряют фото-э.д.с. компенсационным методом. По отградуированной шкале отсчетного потенциометра снимают значение поглощения.
Цель работы: Ознакомление с применением фотоколориметрического метода для анализа шестивалентного хрома путем измерения концентрации его окрашенного комплекса с дифенилкарбазидом в кислой среде.
Оборудование и реактивы:
Фотоэлектроколориметр марки КФК-3
Посуда:
Мерная колба на1 л для приготовления раствора бихромата калия;
Мерные колбы на 100 мл для разбавления растворов при построении калибровочного графика – 10 шт;
Мерные колбы на 250 мл для приготовления хромсодержащих растворов - 3 шт;
Мерный цилиндр на 100 мл для дистиллированной воды;
Бюретки на 25 мл - 3 шт;
Химический стакан на 300 мл для проведения реакции восстановления - 2шт;
Бюксы для взвещивания солей -2 шт.
Пипетки - 2 шт на 1 мл , 2 шт на 2мл и 1 шт на 10 мл.
Реактивы:
Дифенилкарбазид, 0,1%-ный спиртовый раствор
Серная кислота, 2 н. раствор
Фосфорная кислота (конц.)
Стандартный раствор бихромата калия: точную навеску 2,827 г высушенного при 140 0С бихромата калия растворяют в мерной колбе емкостью 1 л и доводят объем раствора до метки дистиллированной водой. Концентрация хрома в стандартном растворе составляет 1 мг/мл.
