Ароматическое строение; энергия резонанса (сопряжения) на примерах: бензол, нафталин, гетероциклические соединения
Среди соединений, содержащих замкнутую сопряженную систему π-электронов, интересны ароматические соединения. Несмотря на высокую степень ненасыщенности, ароматические соединения устойчивы к действию окислителей и температуры, они более склонны вступать в реакции замещения, а не присоединения. Эти соединения обладают повышенной термодинамической стабильностью по сравнению с сопряженными системами с открытой цепью. Известна также тенденция некоторых циклических соединений превращаться при благоприятных условиях в ароматические.
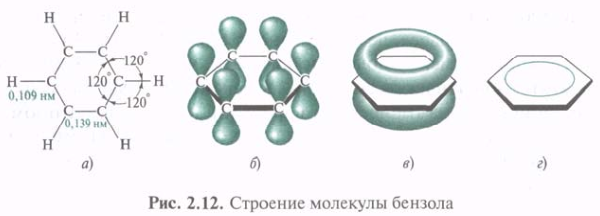
К ароматическим соединениям прежде всего относятся бензол и вещества, сходные с ним. Но могут иметь и существенно отличающуюся структуру. Замкнутая цепь может состоять не только из 12С (карбоциклы), но и содержать гетероатомы (гетероциклы). Единая замкнутая система π-электронов может образовываться посредством как π,π-, так и р,π-сопряжения. Совокупность характерных свойств сопряженных систем была объединена понятием ароматичности. В 1865 г. Ф. А. Кекуле предложил описывать бензол при помощи двух структур, между которыми осциллирует молекула бензола. Но индивидуальная структура Кекуле не может объяснить симметрию и характерную реакционную способность бензола. Бензол представляет собой плоский правильный шестиугольник с валентными углами 120°. Все 12С-12С связи равноценны, длина их составляет 0,139 нм, т. е. является промежуточной между длинами одинарной и двойной связей. Все 12С находятся в sp2-гибридизации, и все σ-связи С—С и С—Н в одной плоскости.
Каждый 12С в молекуле бензола имеет одну негибридизованную р-орбиталь. Шесть этих орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. При их взаимном перекрывании образуется единое π-электронное облако, т. е. осуществляется круговое сопряжение. π-Электронная плотность равномерно распределена по всей циклической системе.
Определение теплот сгорания или гидрирования циклических соединений и сравнение экспериментальных значений с рассчитанными, исходя из предположения, что соединение содержит только изолированные двойные связи, является одним из доказательств ароматичности. При гидрировании циклогексена до циклогексана выделяется 120 кДж/моль теплоты.
Если представить бензол структурой Кекуле с тремя двойными связями, то теплота гидрирования бензола должна быть в три раза больше теплоты гидрирования циклогексена:
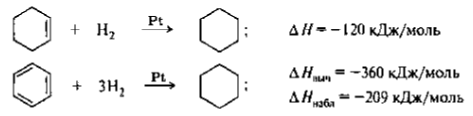
Экспериментально определяемая величина намного меньше. Следовательно, бензол обладает меньшей энергией, чем гипотетический циклогексатриен. 151 кДж/моль - эмпирическую энергию сопряжения (энергию делокализации). Для бензола энергия сопряжения на порядок выше, чем для бутадиена-1,3. Чтобы нарушить ароматическую систему бензола, нужно затратить количество энергии, равное этому значению.
Критерии ароматичности. На основании теоретических расчетов и экспериментального изучения циклических сопряженных систем было установлено, что соединение ароматично, если оно имеет:
• плоский циклический σ-скелет;
• сопряженную замкнутую π-электронную систему, охватывающую все атомы цикла и содержащую 4п+ 2π-электронов, где п = 0, 1, 2, 3 и т. д. – правило Хюккеля.
Критерии ароматичности позволяют отличать сопряженные ароматические системы от всех других. Бензол содержит секстет π-электронов и соответствует правилу Хюккеля при п = 1.
Конденсированные ароматические системы. Правило Хюккеля было сформулировано для плоских моноциклических систем. Но его можно применить и к плоским конденсированным системам, в которых нет атомов, являющихся общими более чем для двух циклов. К таким системам относятся многоядерные ароматические углеводороды — нафталин, антрацен, фенантрен:
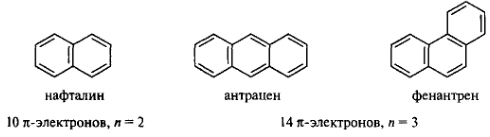
В этих соединениях все атомы углерода находятся в состоянии sp2-гибридизации, циклический σ-скелет плоский, π-электронное облако охватывает все атомы углерода циклов, число π-электронов подчиняется правилу Хюккеля. В конденсированных аренах нет полной выравненности электронной плотности, и они менее термодинамически стабильны.
Многие ароматические полициклические углеводороды обладают канцерогенными свойствами и интенсивно изучаются в связи с проблемами возникновения и профилактики рака. Некоторые канцерогенные ароматические соединения обнаружены в табачном дыме.
Небензоидные ароматические соединения. Существуют циклические сопряженные системы, не содержащие шестичленных циклов, но соответствующие критериям ароматичности и обладающие ароматическими свойствами. Правило Хюккеля не ограничивает проявление ароматичности только нейтральными частицами. Ароматическими могут быть карбанионы и карбокатионы.
Нейтральная молекула циклопентадиена не является ароматической, (один 12С в sp3-гибридизации и не имеет р-АО, цикл не плоский). Атомы водорода метиленовой группы весьма подвижны. При действии на циклопентадиен натрием в тетрагидрофуране или гидридом натрия в 1,2-диметоксиэтане отщепляется протон и образуется циклопентадиенид-ион:
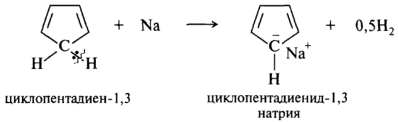
После разрыва связи С—Н у 12С остается два электрона. Теперь все атомы углерода находятся в sp2-гибридном состоянии, в молекуле имеются плоский циклический σ-скелет и единая замкнутая сопряженная система, содержащая на пяти p-орбиталях шесть π-электронов. Это соответствует всем критериям ароматичности. Чтобы отразить равномерное распределение «-» заряда, циклопентадиенид-ион изображают структурой с кружком и знаком «минус» в кружке:

Циклопентадиенид-ион это π-избыточная система, выступать донором электронной плотности по отношению к атомам или молекулам с вакантными орбиталями. Он образует с ионами металлов металлоцены (ферроцен). В ферроцене ион железа находится на равном расстоянии между двумя параллельными плоскостями циклопентадиенид-ионов - «сендвичевая структура». Производное ферроцена — ферроцерон — стимулирует процессы кроветворения и применяется при анемиях.
Циклогептатриен — циклическая система, содержащая семь 12С и 6 π-электронов. И в этом случае 12С метиленовой группы находится в состоянии sp3-гибридизации и не имеет p-орбитали. При отщеплении от метиленовой группы водорода в виде гидрид-иона образуется циклогептатриенил-катион (тропилий-катион):
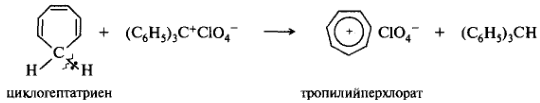
В тропилий-катионе седьмая р-орбиталь вакантна и перекрывается с соседними p-орбиталями с образованием единой сопряженной системы. Он удовлетворяет критериям ароматичности. Положительный заряд равномерно распределяется по всей системе. Семичленное кольцо лежит в одной плоскости, расстояния С—С равны 0,140 нм. В природе распространена семичленная ароматическая система трополона. Некоторые производные трополона являются природными антибиотиками — фунгицидами.
Еще одним примером небензоидных ароматических соединений - азулен. Это углеводород, содержащий конденсированные семичленный и пятичленный циклы. Каждый из 10 12С находится в состоянии sp2-гибридизации. Единая сопряженная система содержит 10 π-электронов. Азулен ароматичен и обладает высокой энергией стабилизации (180 кДж/моль). В отличие от других ароматических углеводородов, азулен (I) обладает дипольным моментом. Наличие дипольного момента заставляет предполагать, что значительный вклад в строение азулена вносит структура (II), в которой одно кольцо представляет собой циклопентадиенид-ион, а второе — ароматический тропилий-катион:

