Свойства идеальных растворов
Коллигативныминазывают такие свойства раствора, которые зависят только от концентрации растворенного вещества и природы растворителя, но не зависят от природы растворенного вещества.
Коллигативные свойства раствора — это свойства идеального раствора.
Идеальными растворами считаются растворы, соответствующие двум требованиям:
1. Размеры молекул всех компонентов раствора нулевые.
2. Силы взаимодействия между всеми компонентами раствора отсутствуют.
Идеальные растворы. Физической моделью идеального раствора является совокупность невзаимодействующих частиц, имеющая объем, аддитивно складывающийся из объемов отдельных компонентов. Наиболее важными свойствами идеальных растворов являются:
а) идеальные растворы образуются из чистых компонентов, находящихся в том же агрегатном состоянии, что и раствор, без теплового эффекта;
б) объем идеального раствора, образованного из чистых компонентов, находящихся в том же агрегатном состоянии, что и раствор, аддитивно складывается из объемов отдельных компонентов.
Идеальнымназывают раствор, в котором не происходят химические реакции между компонентами, а сила межмолекулярного взаимодействия однородных и разнородных частиц одинакова.
Соответственно, образование этих растворов не сопровождается тепловым эффектом (ΔН = 0) и каждый компонент ведет себя в растворе независимо от других компонентов.К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества.Из реальных растворов таким требованиям соответствуют только разбавленные и совершенные растворы.Разбавленными называют растворы, в которых концентрация растворенного вещества приближается к нулю.Совершенными называются растворы, образованные веществами с очень близкими физико-химическими свойствами.
Предельно разбавленным раствором называют раствор, в котором свойства растворителя практически остались неизменными по сравнению с чистым растворителем ввиду низкой концентрации раствора, в то время как свойства растворенного вещества могут очень сильно отличаться от его свойств в чистом виде ввиду попадания в среду растворителя. Свойствами предельно разбавленных растворов обладают обычно все разбавленные растворы вплоть до определенной концентрации, характерной для каждой системы. Чем ближе свойства компонентов, тем до более высокой концентрации сохраняют их растворы свойства предельно разбавленных растворов. Для растворов электролитов этот предел очень низок, так как ионы заметно изменяют свойства растворителя уже при миллимолярных концентрациях.
Реальные растворы. Различные свойства реальных растворов в той или иной степени отклоняются от идеальных (например, термодинамические). Для адекватного описания этих отклонений обычно требуются различные физические модели, учитывающие межчастичные парные и коллективные взаимодействия, размеры частиц, расстояния между ними и т.д. В некоторых простейших случаях такие модели приводят к результатам, хорошо совпадающим с экспериментом. Однако наиболее универсальный и полностью формальный способ учета неидеальности компонентов раствора был предложен Г. Льюисом в 1907 г., который сохранил ту же форму выражения химического потенциала компонента в реальном растворе, что и в идеальном, но вместо концентрации компонента использовал в нем активности.
По концентрации растворенного вещества растворы можно подразделить на концентрированные (с большой концентрацией растворенного вещества) и разбавленные (с малой концентрацией растворенного вещества).
Коллигативными свойствами раствора называются свойства, зависящие от концентрации частиц растворенного вещества и мало или совсем не зависящие от природы растворителя. К таким свойствам относят:
-осмотическое давление;
-давление насыщенного пара растворителя;
-понижение температуры замерзания раствора;
-повышение температуры кипения раствора.
Осмотическое давление
Все растворы независимо от агрегатного состояния обладают способностью к диффузии. Диффузия – это свойство вещества равномерно распределяться по всему предоставленному объему.
Скорость диффузии в газах велика, в твердых телах при обычных температурах диффузия может длиться годами.
Если в сосуд налить концентрированный раствор, а сверху налить чистый растворитель, то диффузия будет протекать в обоих направлениях: растворенное вещество будет диффундировать в растворитель, а растворитель – в раствор (рис. 4.5). Если раствор и растворитель разделить пленкой, через которую проходят только молекулы растворителя и не проходят молекулы растворенного вещества (полупроницаемая мембрана), то будет наблюдаться только односторонняя диффузия растворителя в раствор.

Рис. 4.5 Диффузия
В ходе диффузии некая первоначальная упорядоченность в распределении веществ сменяется полной беспорядочностью их распределения. При этом энтропия системы возрастает. Когда концентрация раствора во всем его объеме выравнивается, энтропия достигает максимума и диффузия прекращается.
Иначе будет обстоять дело, если между двумя растворами поместить перегородку, через которую растворитель может проходить, а растворенное вещество – не может. Такие перегородки получили название полупроницаемых. Если два сосуда соединить полупроницаемой перегородкой и налить в один из них раствор, а в другой растворитель, то молекулы растворителя будут перемещаться из второго сосуда во первый(рис. 4.6). Такойпроцесс односторонней диффузии растворителя в раствор через полупроницаемую мембрану называется осмосом.
| растворитель |
| раствор |
Рис. 4.6 Осмос растворителя через полупроницаемую мембрану
Процесс диффузии будет идти до наступления равновесия, т.е до тех пор, пока не выровняются концентрации растворов, либо до уравновешивания давлений: по мере диффузии растворителя объем раствора увеличивается и возрастает давление на мембрану со стороны раствора. Таким образом, возникает гидростатическое давление, препятствующее диффузии растворителя. При некотором давлении наступает равновесие: сколько молекул растворителя пройдет в раствор, столько же вытеснит обратно увеличившимся давлением.
Равновесное давление раствора, препятствующее диффузии растворителя через полупроницаемую мембрану, называется осмотическим давлением.
В 1886 г. Вант-Гофф сформулировал закон (закон Вант-Гоффа), согласно которому «в разбавленном растворе растворенное вещество ведет себя подобно идеальному газу» и показал, что для растворов неэлектролитов невысоких концентраций осмотическое давление (π) равно:
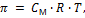
где СМ – молярная концентрация;R – газовая постоянная; Т – температура.
Если в данное уравнение подставить выражение молярной концентрации: (mВ – масса растворенного вещества, MВ – молярная масса растворенного вещества, V – объем раствора), получится полная аналогия уравнения Вант-Гоффа с уравнением состояния идеального газа Менделеева-Клайперона:
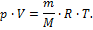
Осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворенное вещество, если бы при данной температуре оно в виде газа занимало объем раствора.
Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается осмос.
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением является гипертоническим по отношению ко второму, а второй – гипотоническим по отношению к первому. При помещении клеток в изотонический раствор они сохраняют свой размер и нормально функционируют.
Большинство растительных клеток существуют вгипотоническом растворе. В силу этого поглощающий водупротопластувеличивается в объеме, плазматическая мембрана растягивается и давит на клеточную стенку, которая, однако, не разрывается. Давление внутриклеточного раствора, развиваемое в результате, главным образом,осмоса, создает так называемое тургорное давление, которому противостоит равное по величине механическое давление клеточной стенки, направленное внутрь. Тургорное давление определяет тургор растений (их упругость). Потеря тургора растительными клетками в результате уменьшения количества воды во внешней среде ведет к увяданию, опусканию листьев и стеблей. На уровне клетки это выражается в явленииплазмолиза- сжатиипротопластапри удалении воды извакуолейи отделении плазматической мембраны от клеточной стенки. Чисто искусственно плазмолиз может быть вызван путем помещения клетки вгипертонический раствор.
При помещении клеток в гипотонический раствор вода из менее концентрированного внешнего раствора переходит внутрь клеток, что приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Такое разрушение клеток называется лизисом, в случае эритроцитов этот процесс называется гемолизом. Кровь с клеточным содержимым, выходящим наружу при гемолизе, за свой цвет называется лаковой кровью.
При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор, и наблюдается сморщивание (высушивание) клеток. Это явление называется плазмолизом.
Биологические жидкости человека (кровь, лимфа, тканевые жидкости) представляют собой водные растворы низкомолекулярных соединений – NaCl, KCl, высокомолекулярных соединений (ВМС) – белков, полисахаридов, нуклеиновых кислот и форменных элементов – эритроцитов, лейкоцитов, тромбоцитов. Их суммарным действием определяется осмотическое давление биологических жидкостей.
Осмотическое давление крови человека при 310 К (37°С) составляет 780 кПа (7,7 атм). Такое же давление создает и 0,9%-ный водный раствор NaCl (0,15 моль/л), который, следовательно, изотоничен с кровью (физиологический раствор). Однако в крови кроме ионов Na+ и Сl- имеются и другие ионы, а также ВМС и форменные элементы. Поэтому в медицинских целях более правильно использовать растворы, содержащие те же компоненты и в том же количестве, что и входящие в состав крови. Эти растворы применяют в качестве кровезаменителей в хирургии.
Человеческий организм, помимо осмотического давления, характеризуется постоянством (гомеостазом) и других физико-химических показателей крови например кислотности. Допустимые колебания осмотического давления крови весьма незначительны и даже при тяжелой патологии не превышают нескольких десятков кПа.При различных процедурах в кровь человека и животных в больших количествах можно вводить только изотонические растворы.При больших потерях крови (например, после тяжелых операций, травм) больным вводят по несколько литров изотонического раствора для возмещения потери жидкости с кровью.
Явление осмоса широко используют в медицинской практике. Так, в хирургии применяют гипертонические повязки (марлю, смоченную в гипертоническом 10%-ном растворе NaCl), которые вводят в гнойные раны.По закону осмоса ток жидкости раны через марлю направляется наружу, в результате чего рана постоянно очищается от гноя, микроорганизмов и продуктов распада.
