ТЕМА: Анализ смеси катионов первой группы 1 страница
Условия проведения опыта
1. При выполнении опыта необходимо брать избыток реактива Несслера, так как осадок растворим в солях аммония.
2. Открытию катиона NH4+ мешают катионы Fe3+, Cr3+, Co2+, Ni2+ и другие.
3. В присутствии этих катионов ведут, добавляя 50% раствор тартрата калия КNaC4H4O6, который с большинством катионов дает комплексные соединения.
Контрольная задача
ТЕМА: Анализ смеси катионов первой группы
Ход анализа:
1. Катион NH4+ можно открыть в присутствии катионов К+ и Na+ реактивом Несслера или реакцией с гидроксидом натрия.
Открытию катионов К+ и Na+. Поэтому, если мешает катион NH+. Поэтому, если в исследуемом растворе обнаружен катион NH4+, перед открытием катионов калия и натрия его следует удалить из раствора. Для этого возьмите 15-20 капель исследуемого раствора, поместите в тигель или в фарфоровую чашку и выпарьте досуха. Осадок в тигле прокалите до полного прекращения выделения белого “дыма”. Охладите содержимое тигля и обработайте 8-10 каплями дистиллированной воды, тщательно перемешайте, после этого проверьте на полноту удаления аммония. Только после отрицательной реакции на реактив Несслера можно приступить к открытию катионов.
2. Обнаружение катиона К+. На 2-3 капли исследуемого раствора подействуйте 3-4 каплями раствора гексанитро-(III) кобальтата натрия, дайте постоять. Желтый осадок гексанитро-(III) кобальтата натрия-калия K2Na[Co(NO2)6] укажет на присутствие катиона К+.
Проведите реакцию на катион К+ гексанитро-(II) купрата натрия-свинца Na2Pb[Cu(NO2)6] и рассмотрите осадок под микроскопом.
3. Катион Na+ обнаруживается дигидроантимонатом в присутствии катионов К+. Возьмите 3-4 капли сконцентрированного путем выпаривания исследуемого раствора, прибавьте в пробирку такое же количество дигидроантимоната калия и потрите о стенки пробирки стеклянной палочкой. Убедитесь, что осадок кристаллический. Не забудьте соблюдать все условия открытия катиона Na+.
Две капли исследуемого раствора выпарьте на предметном стекле, дайте остыть и обработайте каплей раствора уранилацетата. После проведения работы сделайте вывод о присутствии катионов первой группы в исследуемом растворе.
Лабораторная работа №2
ТЕМА: Вторая аналитическая группа катионов (анализ катионов группы хлороводородной кислоты)
Групповой реагент – хлороводородная кислота.
Катионы Ag+, Pb2+, [Hg2]2+ при взаимодействии с хлороводородной кислотой образуют труднорастворимые в воде и в разбавленных кислотах осадки:
AgNO3 + HCl → AgCl↓ + HNO3
Ag+ + Cl-→ FgCl↓
Pb(NO3)2 + 2HCl → PbCl2↓ + 2HNO3
Pb2+ + 2Cl-→ PbCl2↓
Hg2(NO3)2 + 2HCl → Hg2Сl2↓ + 2HNO3
[Hg2]2+ + 2Cl-→ Hg2Cl2↓
Cледует избегать избытка и использования концентрированной хлороводородной кислоты, так как могут образоваться растворимые комплексные соединения:
AgCl + 2HCl → H2[AgCl3] , PbCl2+ HCl→ H[PbCl3]
При температуре воды 100° растворимость хлорида свинца увеличивается в три раза, в то время как растворимость хлорида серебра и хлорида ртути практически остается прежней. Это свойство используется для определения катионов Pb2+ от катионов [Hg2]2+ и Ag+.
Хлорид ртути при взаимодействии с раствором аммиака образует хлорид димеркураммония, который неустойчив и разлагается на малорастворимый меркураммоний и металлическую ртуть, которая придает осадку черный цвет:
Hg2Cl2 + 2NH4OH → [Hg2NH2]Cl↓ + NH4Cl + 2H2O
Hg2Cl2 + 2NH4OH → [Hg2NH2]Cl↓ + Cl- + 2H2O
[Hg2NH2]Cl→ [NH2Hg]Cl + Hg↓
Это позволяет отделять катион[Hg2]2+ от катиона Ag+.
Хлорид серебра хорошо растворим под действием аммиака с образованием комплексной соли:
AgCl + 2NH4OH→ [Ag(NH3)2]Cl + 2H2O
AgCl + 2NH4OH→ [Ag(NH3)2]++ Cl-+ 2H2O
Частные реакции катионов Ag+
1. Гидроксиды калия и натрия KOH и NaOH образуют с катионом Ag+ бурый осадок оксида серебра Ag2О:
AgNO3 + KOH → AgOH↓ + KNO3
Ag+ +OH- → AgOH; AgOH→ Ag2O↓ + H2O
Оксид серебра (I) растворяется в растворе аммиака NH3:
Ag2O + 4NH4OH → 2[Ag(NH3]2OH + H2O
2. Хромат калия K2CrO4 дает с катионом Ag+ осадок хромата серебра Ag2CrO4 кирпично-красного цвета:
K2CrO4 + 2AgNO3 → Ag2CrO4↓ +2KNO3
CrO42- + 2Ag2+→ Ag2CrO4
Опыт. Возьмите в пробирку 2-3 капли раствора нитрата серебра и добавьте 3-4 капли дистиллированной воды и 1-2 капли хромата калия. Обратите внимание на цвет осадка и проверьте его растворимость.
Условия проведения опыта.
1. Реакцию следует проводить при рН= 6,5 – 7,5.
2. В аммиачной и сильно кислой среде осадок не образуется.
3. Ионы Pb2+, Ba2+ и др., образующие с CrO42- осадки, мешают проведению реакции.
3. Бромид и иодид калия KBr и KI образуют с катионом Ag+ бледно-желтый осадок бромида серебра AgBr и желтый осадок иодида серебра AgI: KBr + AgNO3 → AgBr↓ + KNO3; Ag+ + Br-→ AgBr↓
KI + AgNO3-→ AgI↓ + KNO3; Ag+ + I-→ AgI↓
Частные реакции катиона Pb2+
1. Гидроксиды КОН и NaOH образуют с катионом Pb2+ белый осадок Pb(OH)2, растворимый как в кислтах, так и в концентрированных растворах гидроксидов:
Pb(NO3)2 + 2 NaOH→ Pb(OH)2↓ + 2NaNO3
Pb2+ + 2OH-→ Pb(OH)2¯
При действии избытка гидроксида образуется плюмбит натрия:
Pb(OH)2+ 2NaOH → Na2PbO2
2. Серная кислота и сульфаты осаждают катионы Pb2+ выпадает белый осадок PbSO4. При нагревании сульфатов свинца с растворами гидроксидов образуются плюмбиты:
PbSO4 + 4КОН → К2PbO2 + K2SO +2H2O
PbSO4 + 4OH- → PbO22-+ 2H2O
Сульфат свинца растворяется в 30% растворе ацетата аммония:
2 PbSO4 + 2СН3СОО- → [Pb(CH3COO)2PbSO4] + SO42-
Азотная и хлороводородная кислоты повышают растворимость сульфата свинца, так как ионы Н+ связываются ионами SO42- с образованием аниона НSO4- : PbSO4 ↔ Pb2+ + SO42-
HNO3 ↔ NO3- +H+; H++ SO4-↔ HSO4 -
3. Хромат калия К2СrO4 и дихромат калия K2Cr2O7 образуют с катионом Pb2+ малорастворимый хромат свинца желтого цвета:
Pb2+ + CrO42-→ PbCrO4
Хромат свинца растворим в гидроксидах, но не растворим в уксусной кислоте.
4. Ион I- образует с катионом Pb2+ желтый осадок:
Pb2++ 2I- → PbI2↓
Опыт: Получите осадок иодида свинца PbI2, возьмите часть его и прибавьте несколько капель воды и 2н раствора уксусной кислоты и нагрейте. Осадок растворяется, но при охлаждении вновь образуется в виде блестящих золотистых кристаллов.
Условия проведения опыта:
1. Реакцию проводят при рН= 3-5.
2. В избытке KI осадок PbI2 растворяется, образуя комплексное соединение K2[PbI4].
3. Эта реакция катионов Pb2+ позволяет открыть их в присутствии всех катионов аналитических групп.
5. Дифенилкарбазон (дитизон)
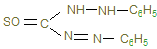
образует с солями свинца внутрикомплексное соединение, окрашенное в кирпично-красный цвет. Реакция чувствительная.
Частные реакции катиона [Hg2]2+
Все соли ртути ядовиты!
1. Гидроксиды образуют с катионом [Hg2]2+ черный осадок оксида ртути(I):
Hg2(NO3)2 + 2NaOH → Hg2O↓ + 2NaNO3 + H2O
[Hg2]2+ + 2OH- → Hg2O + H2O
Раствор аммиака с катионом [Hg2]2+ образует хлорид димеркураммония [Hg2NH2]Cl.
2. Хромат калия К2СrO4 дает с катионом [Hg2]2+ красный осадок Hg2CrO4, нерастворимый в гидроксидах и в разбавленной азотной кислоте.
3. Восстановление [Hg2]2+ до металлической ртути. При действии на каплю раствора соли ртути(I) 2-3 каплями свежеприготовленного раствора хлорида олова SnCl2 образуется белый осадок, который при стоянии темнеет вследствие восстановления ионов [Hg2]2+ до металлической ртути:
[Hg2]2+ + 2Сl- → Hg2Cl2↓
Hg2Cl2+Sn2+ → 2Hg↓ +Sn4+ + 2Cl-
4. На медную пластинку поместите каплю раствора соли ртути (I) и дайте постоять. Через некоторое время на пластинке образуется серое пятно – металлическая ртуть. Обмойте пластинку водой и протрите тряпочкой или фильтровальной бумагой, оно становится блестящим:
Hg2(NO3)2+ Сu → Cu(NO3)2 + 2Hg↓
Условия проведения опыта:
1. Медная пластина должна быть предварительно очищена наждачной бумагой.
2. Через 2-3 минуты после нанесения раствора оксида ртути(I) на пластинку, полученное серое пятно надо протереть фильтровальной бумагой.
3. Сильные окислители мешают проведению опыта.
4. Ионы Hg2+, восстанавливающиеся этой реакцией, должны быть удалены.(Работа проводится в вытяжном шкафу!)
5. Дифенилкарбазон с катионом ртути [Hg2]2+ дает соединение фиолетового или синего цвета.
Опыт: Поместите на предметное стекло каплю исследуемого раствора и прибавьте туда каплю 2н раствора азотной кислоты и каплю дифенилкарбазона. Если в растворе имеются катионы [Hg2]2+, то капля окрашивается в синий или фиолетовый цвет. Такую же окраску дают катионы ртути (II) и ионы СrО42-.
Условия проведения опыта:
1. Катионы Нg2+ и анионы СrO42- должны быть удалены.
2. В нейтральных и уксуснокислых растворах катионы Cu2+, Fe2+, Fе3+, Cr3+, Co2+ так же дают окрашенные соединения.
Контрольная задача
ТЕМА: Анализ катионов второй группы
Ход анализа: практически нет ни одного реактива, которым можно было бы открыть тот или иной катион второй группы в присутствии других катионов. Поэтому необходимо применить систематический ход анализа, т.е. последовательно выделить каждый катион из смеси и затем открыть их.
В коническую колбу поместите 20-30 капель исследуемого раствора и, помешивая, добавьте 2н раствор хлороводородной кислоты. Через 1-2 минуты осадок отцентрифугируйте и промойте холодной водой, содержащей несколько капель 2н раствора хлороводородной кислоты. Центрифугат и промывные воды не используются. Осадок обработайте 2-3 раза горячей водой и центрифугируйте. При этом хлорид свинца переходит в раствор, а хлорид серебра AgCl и хлорид ртути Hg2Cl2 остается в осадке. В центрифугате открывают катион Pb2+, а в осадке катионы Ag+, [Hg2]2+.
1. Открытие катионов Pb2+. К 2-3 каплям центрифугата добавьте такое же количество раствора иодида калия – образуется осадок иодида свинца PbI2, который при нагревании растворяется, а при охлаждении вновь выпадает в виде золотисто-желтых кристаллов.
2. Открытие катиона [Hg2]2+. К оставшемуся осадку в пробирке или на фильтре прилейте 5-7 капель раствора аммиака и перемешайте. Если присутствует катион [Hg2]2+, то осадок чернеет. Хлорид серебра под действием раствора аммиака переходит в раствор в виде комплексной соли, с соль [Hg2NH2]Cl и ртуть остается. Отделите осадок.
3. Открытие катиона Аg+. Центрифугат разделите на две части и к одной из них прилейте раствор иодида калия, а к другой – азотной кислоты. При наличии катиона Аg+ в первой пробирке выпадет желтый осадок иодида серебра, а во второй – белый осадок хлорида серебра. В том и другом случае происходит разрушение комплекса:
[Ag(NH3]2 Cl ↔ [Ag(NH3]2]+ + Cl-
[Ag(NH3]2]+ ↔ 2NH3 + Ag+
2NH3 + Ag+ + 2H+ +Cl- ® AgCl¯ +2NH4+
[Ag(NH3]2 Cl + 2HNO3 ® AgCl¯ + NH4NO3
Еще более чувствительной реакцией является реакция с (NH4)2S.
Лабораторная работа №3
ТЕМА: Третья аналитическая группа катионов (анализ катионов группы серной кислоты)
К третьей группе относятся катионы щелочноземельных металлов бария, стронция, кальция. Они имеют законченные 8 электронные внешние слои. Химическая активность их возрастает от кальция к барию. В таком же направлении изменяются и другие свойства, например растворимость солей, основные свойства гидроксидов и др. Ионы этих элементов в водных растворах бесцветны.
Ион SO42-c катионами Ba2+, Sr2+, Ca2+, Pb2+ образует осадки, а с катионами других аналитических групп осадка не дает. Разбавленная серная кислота – групповой реагент.
Соли, образованные сильными кислотами, практически не подвергаются гидролизу.
Поскольку произведение растворимости CaSO4 равно 9,1×10-6, то осаждение катионов Са2+ разбавленной серной кислотой происходит полностью. Чтобы не “потерять” катион Са2+ при анализе, необходимо проводить проверочные реакции на этот катион после осаждения катионов третьей группы групповым реагентом или вести осаждение катионов этой группы смесью серной кислоты с этанолом.
Опыт: Возьмите три центрифужные пробирки, прибавьте по 3-5 капель растворов солей: в первую - хлорида бария, во вторую – хлорида стронция, в третью – хлорида кальция. Добавьте в каждую из них по 3 капли раствора серной кислоты, нагрейте на водяной бане и наблюдайте за образованием осадков.
С повышением температуры растворимость солей BaSO4, SrSO4, CaSO4 изменяется мало, более полное осаждение происходит при стоянии в течение 20 минут. Обратите внимание на скорость выпадения осадков при комнатной температуре. Проверьте растворимость в соляной и азотной кислотах.
После осаждения в пробирку, содержащую сульфат кальция добавьте 5 капель ацетона или этилового спирта и проверьте, увеличивается ли количество осадка. Дайте объяснение.
Карбонат натрия и другие растворимые соли угольной кислоты дают с катионами Ba2+, Sr2+, Ca2+ белые осадки, растворимые в соляной, азотной и уксусной кислотах. Проверьте действие раствора карбоната натрия Na2CO3 или карбоната аммония (NH4)2CO3 на катионы Ba2+, Sr2+, Ca2+ и исследуйте растворимость образовавшихся осадков в соляной и уксусной кислотах.
Частные реакции катиона Ва2+
1. Хромат калия К2CrO4 дает с катионом Ва2+ желтый осадок хромата бария ВаСrO4, нерастворимый в уксусной кислоте, но растворимый в сильных кислотах:
BaCl2 + K2CrO4 ® BaCrO4¯ + 2KCl
Ba2+ + CrO42-® BaCrO4¯
Опыт: Возьмите в пробирку 3 капли раствора хлорида или нитрата бария, добавьте 3 капли раствора хромата калия и 3 капли раствора уксусной кислоты. Нагрейте на водяной бане. При нагревании выпадет желтый осадок - кристаллический хромат бария ВаСrО4.
Условия проведения опыта.
1. Реакция проводится в нейтральной или слабокислой среде.
2. Выпадению осадка способствует нагревание.
3. Катионы Pb2+ и др., дающие с хромат ионом осадки, мешают проведению реакции.
2. Дихромат калия К2Cr2O7 дает с катионом бария также желтый осадок хромата бария:
К2Cr2O7 + BaCl2 + Н2О ® BaCrO4¯ + 2КСl + 2НСl
Cr2O72- + H2O ↔ 2CrO42- + 2H+
2CrO42- + 2Ba2+ ↔ 2BaCrO4¯
В осадок выпадает BaCrO4 , а не BaCr2O7, так как в растворе протекает взаимодействие ионов Cr2O72- c водой. Концентрация образующихся при этом ионов CrO42- вполне достаточна для осаждения иона Ва2+ в виде BaCrO4. Кроме того, эта реакция частично смещается справа налево ацетатной буферной смесью. При взаимодействии дихромат аниона с водой образуются ионы Н+, придающие раствору кислую реакцию. Для связывания ионов Н+ добавляют ацетат натрия:
CH3COONa + H+ ® CH3COOH + Na+
В образовавшейся уксусной кислоте хромат бария не растворяется.
Опыт. Возьмите в пробирку 3 капли раствора хлорида бария или нитрата бария, добавьте 3 капли раствора дихромата калия и 4-5 капель раствора ацетата натрия CH3COONa, нагрейте на водяной бане. При этом выпадает кристаллический осадок хромата бария BaCrO4.
Условия проведения опыта:
1. Реакцию следует проводить при избытке ацетата натрия.
2. Ионы Sr2+, Ca2+ в присутствии ацетатного буферного раствора не мешает открытию иона Ва2+.
Следовательно, для осаждения иона Ва2+ и отделения его от катионов стронция и кальция можно применять как хромат ионы, так и дихромат ионы. Проверьте растворимость хромата бария, стронция и кальция следующим опытом.
Опыт: Возьмите три пробирки и поместите в каждую по 3 капли растворов хлорида бария, хлорида стронция, хлорида кальция и добавьте в каждую по капле раствора хромата калия и по капле раствора уксусной кислоты. Жидкости в пробирках перемешайте стеклянной палочкой и наблюдайте за результатами реакции. Проделайте такой же опыт, но вместо уксусной кислоты добавьте 2-3 капли соляной кислоты.
3.Окрашивание пламени. Летучие соли бария окрашивают бесцветное пламя в желто-зеленый цвет.
Частные реакции катиона Sr2+
Катионы Sr2+ не имеют специфических реакций.
1. Гипсовая вода (насыщенный водный раствор гипса (CaSO4×2H2O) образует с катионом Sr2+ осадок стронция.
Опыт: В пробирку налейте 4 капли раствора нитрата стронция Sr(NO3)2, добавьте 5-6 капель гипсовой воды, нагрейте на водяной бане и наблюдайте образование осадка.
Условия проведения опыта:
1. Реакция с гипсовой водой может применяться при отсутствии катионов Ва2+, а также катионов, которые дают труднорастворимые осадки с анионом SO42-.
2. Нагревание ускоряет образование осадка.
3. Так как осадок SrSO4 появляется не сразу, то следует дать постоять смеси 10 -15 мин.
2. Оксалат аммония (NH4)2C2O4 осаждает катион Sr2+ в виде белого осадка:
Sr(NO3)2 + (NH4)2C2O4 ® SrC2O4¯ + 2NH4NO3
Sr2++ C2O42-® SrC2O4
3. Окрашивание пламени. Соли стронция окрашивают бесцветное пламя в карминово-красный цвет.
Частные реакции катиона Са2+
1. Оксалат аммония (NH4)2C2O4 (и другие растворимые соли щавелевой кислоты) образуют с катионом Са2+ белый кристаллический осадок:
CaCl2 + (NH4)C2O4 ® CaC2O4¯ + 2NH4Cl
Ca2+ + C2O42-® CaC2O4
Опыт: В пробирку налейте 3 капли раствора СaCl2 и добавьте каплю раствора уксусной кислоты, затем прилейте 3 капли оксалата аммония и 1-2 капли раствора аммиака. Выпадает белый кристаллический осадок.
Условия проведения опыта.
1. Вначале осаждение лучше вести пи рН 5-6, а затем при рН 7-8.
2. Катионы Ва2+ и Sr2+ мешают проведению реакции.
Катионы Ва2+ и Sr2+ дают так же белые кристаллические осадки с оксалатом аммония, но произведения растворимости этих соединений различны: ПР(СаС2О4) =2,57×10-9; ПР(SrС2О4) =5,6×10-8; ПР(ВаС2О4)= 1,6×10-7.Следовательно, осадок оксалата кальция можно считать практически нерастворимым в воде. Растворимость оксалатов в уксусной кислоте различна. Оксалат кальция нерастворим, оксалат бария растворяется в уксусной кислоте несколько в большей степени, чем оксалат стронция.
Оксалаты бария, стронция, кальция растворимы в сильных минеральных кислотах (соляной и азотной).
Опыт: Возьмите три пробирки, в каждую налейте по 3 капли растворов хлорида бария, хлорида стронция, хлорида кальция и прилейте в каждую по 3-4 капли раствора оксалата аммония. Наблюдайте образование осадка. После этого добавьте в каждую пробирку по 6 капель раствора уксусной кислоты и посмотрите, где будет происходить частичное растворение осадка. Затем повторите опыт, но вместо уксусной кислоты добавьте 6 капель раствора соляной кислоты. Отметьте, что происходит с осадками.
2. Микрокристаллоскопическая реакция. Образование осадка сульфата кальция СаSО4 × 2Н2О при взаимодействии катиона Са2+ с серной кислотой можно легко заметить, если проводить реакцию на предметном стекле, наблюдая выпавшие кристаллы под микроскопом.
Опыт: Одну каплю раствора соли кальция поместите на предметное стекло, добавьте каплю 2Н раствора серной кислоты и осторожно нагрейте на маленьком пламени газовой горелки до появления белой каймы. По краям капли образуются игольчатые кристаллы в виде пучков или звездочек.
При наличии в растворе катионов Ва2+ и Sr2+ поступают следующим образом: в пробирку вносят 3-4 капли испытуемого раствора, добавляют 4 капли 2Н раствора серной кислоты, нагревают 5-6 минут на водяной бане, при этом ионы Ва2+ и Sr2+ переходят в осадок, а ионы Са2+ остаются в растворе. Осадок отделяют фильтрованием. Каплю фильтрата помещают на предметное стекло и упаривают до появления белой каймы, а затем рассматривают полученные кристаллы под микроскопом.
3. Окрашивание пламени. Летучие соли кальция окрашивают бесцветное пламя горелки в кирпично-красный цвет.
Контрольная задача
ТЕМА:Анализ катионов третьей группы
Предварительные испытания.
К анализируемому веществу прибавляем по каплям гипсовую воду и наблюдаем за выпадением осадка.
| Эффект | катион | ||
| Ва2+ | Sr2+ | Ca2+ | |
| Осадок не образуется | отсутствует | отсутствует | присутствует (для проверки прово-дят реакцию с родизонатом Na |
| Осадок появляется постепенно | ___ | присутствует | может присутствовать |
| Осадок образуется мгновенно | присутствует | может присутствовать | Может присутствовать |
Ход анализа:
Ввиду того, что бихромат калия К2Cr2О7 дает в уксуснокислой среде осадок только с катионом Ва2+, то обычно катионы Ва2+ отделяют от катионов Sr2+ и Са2+, добавляя к испытуемому раствору ацетат натрия и раствор дихромата калия. При этом катионы Ва2+ переходят в осадок в виде ВаСrО4, а катионы Sr2+ и Са2+ и избыток хромат-ионов СrО42- остается в растворе. Осадок отфильтровывают и проверяют полноту отделения бария.
К части фильтрата добавляют гипсовую воду и нагревают на водяной бане 7-10 минут; если при стоянии выпадает осадок, то в растворе находятся катионы стронция.
Если в растворе есть катионы стронция, то к центрифугату (фильтрату), который не содержит гипсовой воды, добавляют раствор карбоната натрия и отделяют осадок карбонатов SrCO3 и СаСО3, промывают его два раза дистиллированной водой, растворяют в уксусной кислоте. К раствору добавляют сульфат аммония, при этом катионы стронция образуют осадок сульфата стронция SrSO4 , а катионы Са2+ (в значительной мере) остаются в растворе в виде комплексной соли (NH4)2[Ca(SO4)2].
Обнаружение и отделение катионов Ва2+.В коническую пробирку берут 3 капли испытуемого раствора, прибавляют 2-4 капли ацетата натрия и 3 капли раствора дихромата калия. Если осадок образуется, то это указывает на присутствие катионов Ва2+. Для удаления катионов бария берут в коническую пробирку 5-6 капель анализируемого раствора, 5-6 капель раствора уксусной кислоты и 5-6 капель дихромата калия, перемешивают стеклянной палочкой, дают стоять 2-3 минуты и отделяют осадок (фильтрованием).
Обнаружение и отделение катионов Sr2+.Фильтрат после проверки на полноту осаждения катионов бария в количестве 2-3 капель помещают в пробирку, при помощи пипетки добавляют 2-3 капли гипсовой воды, нагревают на водяной бане до 70°С и дают стоять 15-20 минут. Образование осадка говорит о присутствии в испытуемом растворе катионов Sr2+. Последний проверяют на пламя. Карминово-красное окрашивание указывает на присутствие катионов стронция.
