Диеновый синтез (реакция Дильса-Альдера)
Основные положения теории химического строения А.М.Бутлерова
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
3. Свойства веществ зависят от их химического строения.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Алканы, Циклоалканы
· . Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи.
Алканы – название предельных углеводородов по международной номенклатуре.
Парафины– исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный).
Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
- Алканы - углеводороды, состав которых выражается общей формулой CnH2n+2, где n – число атомов углерода.
Метан этан пропан бутан пентан гексан гекпант октан нонан декан
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности
Четыре s-связи углерода направлены в пространстве под тетраэдрическим углом 109о28'. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода
В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3- атома углерода образуют более сложную пространственную конструкцию
Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. Это можно показать на примерен-бутана (VRML-модель, 10574 байт) или н-пентана
- Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами.
Различия в порядке соединения атомов в молекулах (т.е. в химическом строении) приводят к структурной изомерии. Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т.е. начиная с бутана С4Н10.
Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия). В этом случае использование структурных формул недостаточно и следует применять модели молекул или пространственные (стереохимические) формулы.
Алканы, начиная с этана С2Н6, существуют в различных пространственных формах, обусловленных внутримолекулярным вращением по s-связям С–С, и проявляют так называемую поворотную изомерию.
Кроме того, при наличии в молекуле 7-ми и более углеродных атомов, возможен еще один вид пространственной изомерии, когда два изомера относятся друг к другу как предмет и его зеркальное изображение (подобно тому, как левая рука относится к правой). Такие различия в строении молекул называют зеркальной, или оптической, изомерией.
Получение алканов
Алканы выделяют из природных источников
(природный и попутный газы, нефть, каменный уголь). Используются также синтетические методы.
- Крекинг нефти (промышленный способ)
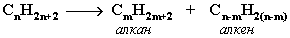
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
- Гидpиpование непpедельных углеводоpодов:
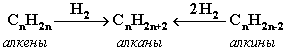
- Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
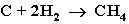
- Из синтез-газа (СО + Н2) получают смесь алканов:
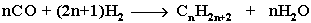
- Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:
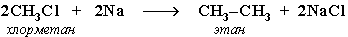
(реакция Вюpца)
- Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма)
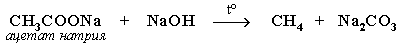
б) электролиз по Кольбе
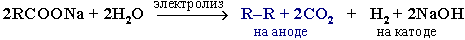
- Разложение карбидов металлов (метанидов) водой:
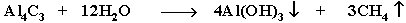
Галогеналканы
Галогенопроизводные алканов (галогеналканы) имеют очень важное значение для синтеза многих соединений. Замена атомов водорода на галоген делает соединение химически активным, т.к. связь углерода с более электроотрицательным атомом галогена является полярной и довольно реакционноспособной в реакциях ионного типа. Полярность ковалентной связи, например С–Cl, приводит к смещению электронной плотности соседних связей в молекуле (индуктивный эффект).
Галогенопроизводные алканов широко применяются для синтеза алканов с заданным строением молекул. Для этого используется реакция взаимодействия их с активными металлами (реакция Вюрца):
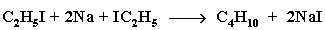
Если в реакции использовать разные галогенопроизводные, то получается смесь трех продуктов. Например:
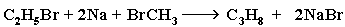
Кроме пропана образуются бутан C4H10 (из 2-х молекул C2H5Br) и этан C2H6 (из 2-х молекул CH3Br).
Для галогенпроизводных характерно замещение галогена на другие группы атомов при действии воды, оснований и солей. Эти реакции протекают по механизму нуклеофильного замещения (SN), т.к. положительно заряженный углеродный атом, связанный с галогеном, является центром атаки нуклеофильными частицами (OH-, OR-, CN-, NH2- и др.).
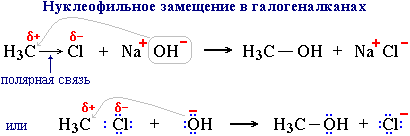
Под действием нуклеофильного реагента (донора пары электронов) OH- происходит гетеролитический разрыве полярной связи С-Cl. Электронная пара этой связи отходит к более электроотрицательному атому Cl, который превращается в анион Cl-(анимация).
Нуклеофильное замещение в общем виде
Y: + RX ® RY + X:
Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи
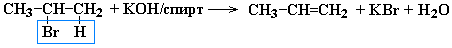
Изомеризация алканов
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов.
Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия:
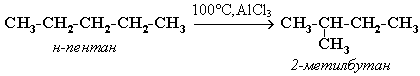
Исходное вещество и продукт реакции изомеризации имеют одинаковые молекулярные формулы и являются структурными изомерами (изомерия углеродного скелета).
Физические свойства
· При нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; начиная с C14H30 и далее — твёрдые вещества.
· Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
· Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
· Окта́новое число́ (от [изо]октан) — показатель, характеризующий детонационную стойкость топлива (способность топлива противостоять самовоспламенению при сжатии) для двигателей внутреннего сгорания. Число равно содержанию (в процентах по объёму) изооктана (2,2,4-триметилпентана) в его смеси с н-гептаном, при котором эта смесь эквивалентна по детонационной стойкости исследуемому топливу в стандартных условиях испытаний.
· Изооктан трудно окисляется даже при высоких степенях сжатия, и его детонационная стойкость условно принята за 100 единиц. Сгорание в двигателе н-гептана даже при невысоких степенях сжатия сопровождается детонацией, поэтому его детонационная стойкость принята за 0. Для бензинов с октановым числом выше 100 создана условная шкала, в которой используют изооктан с добавлением различных количеств тетраэтилсвинца.
· Циклоалканы (циклопаpафины, нафтены, цикланы, полиметилены) – предельные углеводороды с замкнутой (циклической) углеродной цепью.
Атомы углерода в циклоалканах, как и в алканах, находятся в sp3–гибридизованном состоянии и все их валентности полностью насыщены.
Простейший циклоалкан – циклопpопан С3Н6 – представляет собой плоский трехчленный карбоцикл (аним. 3.0.1, 46418 байт).
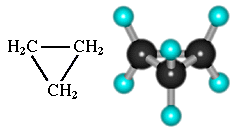
Остальные циклы имеют неплоское строение вследствие стремления атомов углерода к образованию тетраэдрических валентных углов.
По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки "цикло" (циклопропан, циклобутан, циклопентан, циклогексан и т.д.). При наличии в цикле заместителей нумерацию атомов углерода в кольце проводят так, чтобы ответвления получили возможно меньшие номера. Так, соединение
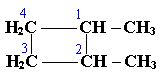
следует назвать 1,2-диметилциклобутан, а не 2,3-диметилциклобутан, или 3,4-диметилциклобутан.
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы. Напpимеp, бутан имеет фоpмулу С4Н10, а циклобутан – С4Н8. Поэтому общая формула циклоалканов СnH2n. Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле.
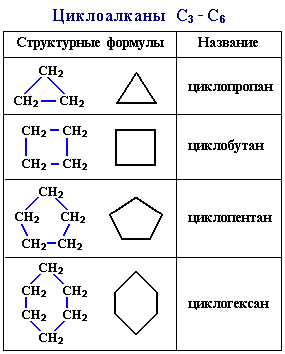
изические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур.
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
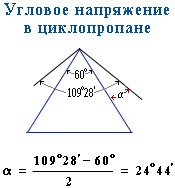
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
Малые циклы (С3 – С4) довольно легко вступают в реакции гидрирования:
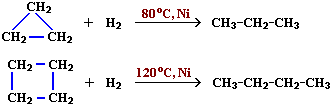
Циклопропан и его производные присоединяют галогены и галогеноводороды:
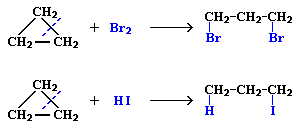
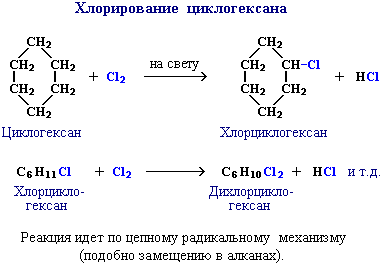
В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
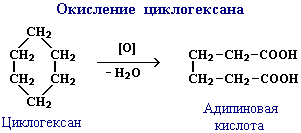
Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
1. Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий – нафтены). При переработке нефти выделяют главным образом циклоалканы С5 - С7.
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца) приводит к образованию различных циклоалканов:
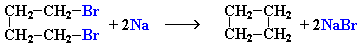
(вместо металлического натрия используется также порошкообразный цинк).
Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения. Например, для синтеза 1,3-диметилциклопентана следует использовать 1,5-дигалоген-2,4-диметилпентан:
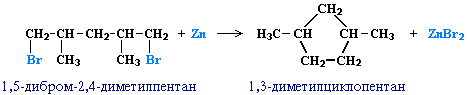
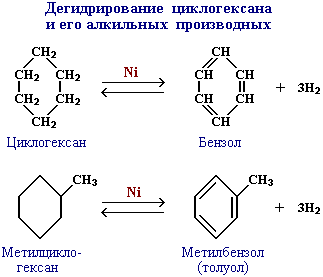
Существуют и другие методы получения циклоалканов. Так, например, циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
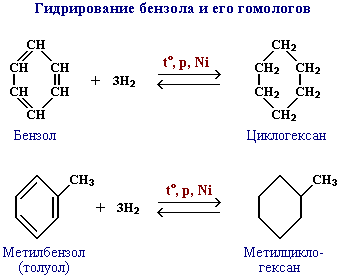
Для циклоалканов характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Пространственная
3. Межклассовая изомерия с алкенами
Реакции замещения
В молекулах алканов связи C-Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C-C. В определенных условиях происходит разрыв именно С-Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов.
1. Галогенирование
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании.
Хлорирование метана:
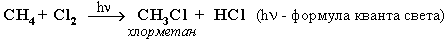
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
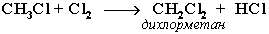
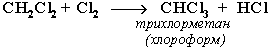
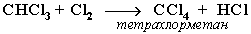
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
В разработке теории цепных реакций большую роль сыграли труды академика, лауреата Нобелевской премии Н.Н. Семенова.
Механизм радикального замещения (символ SR):
1 стадия – зарождение цепи - появление в зоне реакции свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl:Cl на два атома хлора с неспаренными электронами (свободные радикалы) Cl:
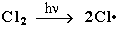
2 стадия – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений:
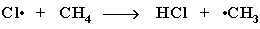
(Реакция Cl + CH4 CH3Cl + H не идет, т.к. энергия атомарного
водорода H значительно выше, чем метильного радикала СН3).
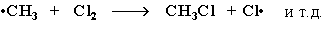
3 стадия – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
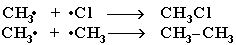
аним. 2.5.1 (33906 байт)
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
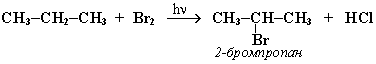
2. Нитрование алканов (реакция Коновалова)
На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO2. Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями.
Схема реакции:
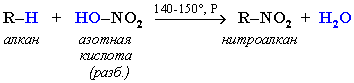
При нитровании алканов также соблюдается порядок реакционной способности С-Н-связей, характерный для реакций радикального замещения:
Стрет.– Н > Свтор.– Н > Cперв.– Н
Например:
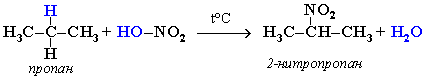
- Крекинг - реакции расщепления углеродного скелета крупных молекул при нагревании и в присутствии катализаторов .
При температуре 450 – 700С алканы распадаются за счет разрыва связей С–С (более прочные связи С–Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов.
Например:
C6H14 C2H6 + C4H8
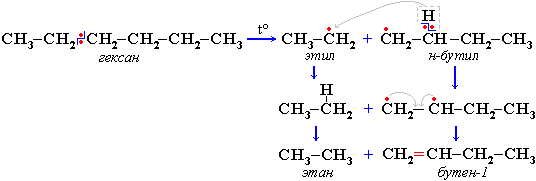
Распад связей происходит гомолитически с образованием свободных радикалов:
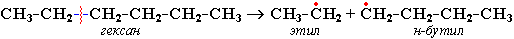
Свободные радикалы очень активны. Один из них (например, этил) отщепляет атомарный водород Н от другого (н-бутила) и превращается в алкан (этан). Другой радикал, став двухвалентным, превращается в алкен (бутен-1) за счет образования –связи при спаривании двух электронов у соседних атомов:
Разрыв С–С–связи возможен в любом случайном месте молекулы. Поэтому образуется смесь алканов и алкенов с меньшей, чем у исходного алкана, молекулярной массой.
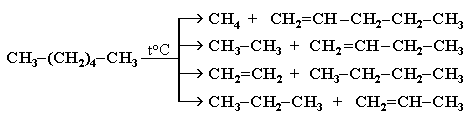
В общем виде этот процесс можно выразить схемой:
CnH2n+2 CmH2m + CpH2p+2, гдеm + p = n
При более высокой температуре (свыше 1000С) происходит разрыв не только связей С–С, но и более прочных связей С–Н. Например, термический крекинг метана используется для получения сажи (чистый углерод) и водорода:
СН4 C + 2H2
Реакции замещения
В молекулах алканов связи C-Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C-C. В определенных условиях происходит разрыв именно С-Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов.
1. Галогенирование
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании.
Хлорирование метана:
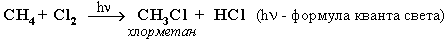
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
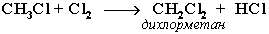
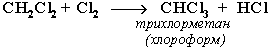
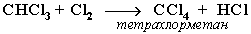
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
В разработке теории цепных реакций большую роль сыграли труды академика, лауреата Нобелевской премии Н.Н. Семенова.
Механизм радикального замещения (символ SR):
1 стадия – зарождение цепи - появление в зоне реакции свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl:Cl на два атома хлора с неспаренными электронами (свободные радикалы) Cl:
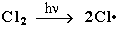
2 стадия – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений:
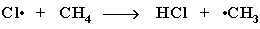
(Реакция Cl + CH4 CH3Cl + H не идет, т.к. энергия атомарного
водорода H значительно выше, чем метильного радикала СН3).
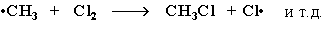
3 стадия – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
аним. 2.5.1 (33906 байт)
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
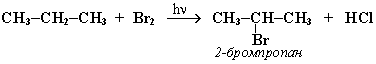
2. Нитрование алканов (реакция Коновалова)
На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO2. Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями.
Схема реакции:
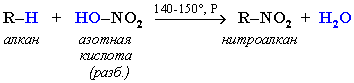
При нитровании алканов также соблюдается порядок реакционной способности С-Н-связей, характерный для реакций радикального замещения:
Стрет.– Н > Свтор.– Н > Cперв.– Н
Например:
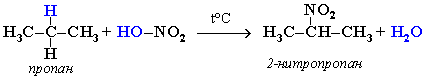
Алкадиены(Диены)
. Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи.
Общая формула алкадиенов СnH2n-2.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах.
1.Изолированные двойные связи разделены в цепи двумя или более
s-связями: СН2=СН–СН2–СН=СН2
Разделенные sp3-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах. Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов.
2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2(аллен)
Подобные диены (аллены) относятся к довольно редкому типу соединений.
3.Сопряженные двойные связи разделены одной s-связью:
СН2=СН–СН=СН2
Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2-атомов углерода.
Отдельные представители этих диенов широко используются в производстве синтетических каучуков и различных органических веществ.
Гидрирование
При гидрировании бутадиена-1,3 получается бутен-2, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами С2 и С3:
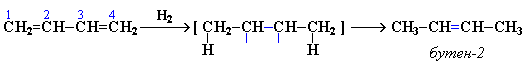
В присутствии катализатора Ni получается продукт полного гидрирования:
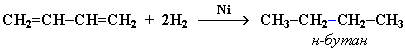
Галогенирование
1,4-присоединение:
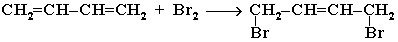
1,2-присоединение:
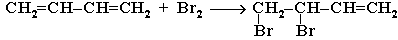
При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах).
К реакциям присоединения относятся реакции полимеризации, характерные для диенов. Этот процесс имеет важное значение в производстве синтетических каучуков.
Диеновый синтез (реакция Дильса-Альдера)
В органическом синтезе широко применяется реакция присоединения к сопряженным диенам соединений, содержащих кратные связи (так называемых диенофилов). Реакция идет как 1,4-присоединение и приводит к образованию циклических продуктов:
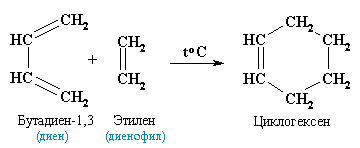
Получение алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:
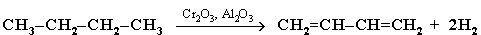
Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
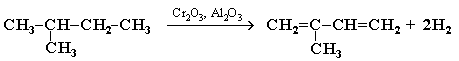
2. Синтез дивинила по Лебедеву:
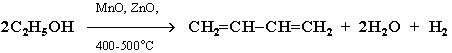
3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
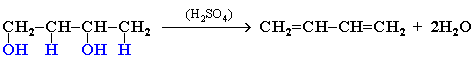
4. Действие спиртового раствора щелочи на дигалогеналканы:
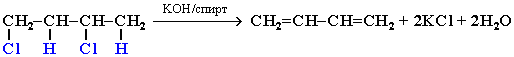
Алкены
· Алкены (этиленовые углеводороды, олефины) - непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов - CnH2n.
Простейшие представители:
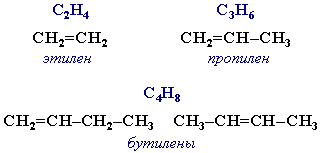
В отличие от предельных углеводородов, алкены содержат двойную связь С=С, которая осуществляется 4-мя общими электронами:
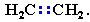
В образовании такой связи участвуют атомы углерода в sp2-гибридизованном состоянии (часть I, раздел 4.3.2). Каждый из них имеет по три 2sp2-гибридных орбитали, направленных друг к другу под углом 120°, и одну негибридизованную 2р-орбиталь, расположенную под углом 90° к плоскости гибридных АО.
Номенклатура алкенов
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен:
2 атома С этан этен;
3 атома С пропан пропен и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен. Например:
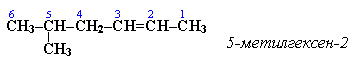
Для простейших алкенов применяются также исторически сложившиеся названия:этилен (этен), пропилен (пропен), бутилен(бутен-1), изобутилен (2-метилпропен) и т.п.
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
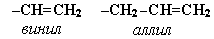
· Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
· При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гексадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Получение алкенов
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов:
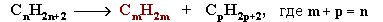
Например:
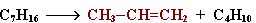
II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи.
- Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи
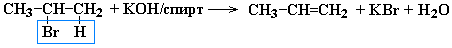
- Дегидратация спиртов
при температуре менее 150C в присутствии водоотнимающих реагентов
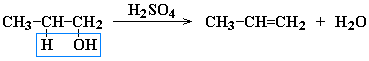
Реакции элиминирования идут в соответствии с правилом Зайцева:
Отщепление атома водорода в реакциях дегалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов.
Такие алкены обладают более низкой энергией.
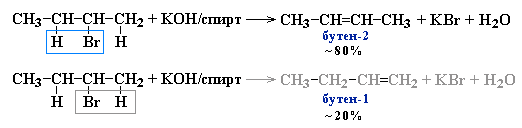
- Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов :
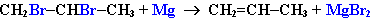
- Дегидрирование алканов при 500С:
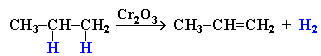
Алкены взаимодействуют с водородом при нагревании в присутствии металлов Pt, Pd или Ni:
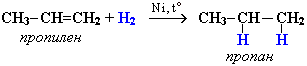
Присоединение водорода к атомам углерода в алкенах приводит к понижению степени их окисления:
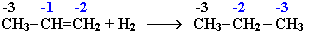
Поэтому гидрирование алкенов относят к реакциям восстановления. Эта реакция используется в промышленности для получения высокооктанового топлива.
