Метод молекулярных орбиталей
Рабочая программа. Метод молекулярных орбиталей. Молекулярная орбиталь как линейная комбинация атомных орбиталей. Понятие о связывающих и разрыхляющих молекулярных орбиталях. Порядок связи. Последовательность увеличения энергии молекулярных орбиталей элементов 1-го и 2-го периодов ПСЭМ. Электронные формулы молекул. Принципы заполнения молекулярных орбиталей. Молекулярные диаграммы двухатомных гомо - и гетероядерных молекул. Магнитные свойства молекул (диамагнетизм и парамагнетизм).
Метод валентных связей позволяет во многих случаях объяснить образование химической связи и предсказать целый ряд свойств молекул. Тем не менее известно много соединений, существование и свойства которых не могут быть объяснены с позиций метода ВС. Более универсальным является метод молекулярных орбиталей (МО).
Метод ВС основан на идее образования химической связи парой электронов, принадлежащей двум атомам. Согласно методу МО электроны, образующие химическую связь, движутся в поле, образуемом ядрами всех атомов, составляющих молекулу, т.е. электроны принадлежат всем атомам молекулы. Следовательно, молекулярные орбитали являются в общем случае многоцентровыми.
Согласно методу МО все электроны данной молекулы, участвующие в образовании химической связи, распределяются по соответствующим молекулярным орбиталям. Каждая молекулярная орбиталь, как и атомная орбиталь, характеризуется своим набором квантовых чисел.
Молекулярные орбитали получают сложением или вычитанием исходных атомных орбиталей. Если МО образуется из атомных орбиталей ψА и ψВ, то при их сложении возникает МО ψ+, а при вычитании – ψ- :
ψ+ = с1ψА + с2ψВ,
ψ- = с3ψА – с4ψВ,
где с1 – с4 – коэффициенты, определяющие долю участия соответствующей атомной орбитали в МО.
Эта операция носит название линейной комбинации атомных орбиталей, поэтому метод носит название МО ЛКАО(молекулярная орбиталь есть линейная комбинация атомных орбиталей). Число образующихся МО равно числу исходных АО. Молекулярные орбитали образуются только из атомных орбиталей с близкими энергиями. Большие различия в энергиях исходных АО препятствуют образованию МО. Орбитали внутренних энергетических уровней не участвуют в образовании МО.
При сложении АО образуются связывающие МО с энергией, меньшей, чем у исходных АО. Вычитание АО ведет к образованию разрыхляющих МО, имеющих более высокую энергию по сравнению с исходными АО. Схема образования связывающих и разрыхляющих МО из 1s атомных орбиталей приведена на рис. 6.11.
Электроны, находящиеся на МО, характеризуются четырьмя квантовыми числам
n – главное квантовое число;
l – орбитальное квантовое число;
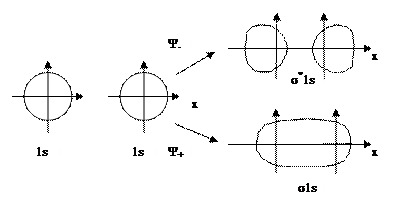
Рис. 6.11. Схема образования связывающей (σ1s) и разрыхляющей (σ*1s) молекулярных орбиталей
λ – молекулярное квантовое число, аналогичное магнитному квантовому числу ml; может принимать значения 0; ±1;±2, обозначаемые буквами σ, π, δ соответственно;
ms – спиновое квантовое число.
Заполнение молекулярных орбиталей электронами подчиняется принципу Паули, принципу наименьшей энергии и правилу Гунда.
Последовательность увеличения энергий МО, т.е. последовательность заполнения, для элементов начала 2-го периода (для азота включительно) имеет вид
σ1s<σ*1s<σ2s<σ*2s<π2pх=π2pz<σ2py< π*2pх=π*2pz <σ*2py ,
а для элементов конца 2-го периода (O, F, Ne) –
σ1s<σ*1s<σ2s<σ*2s< σ2py <π2pх =π2pz < π*2pх=π*2pz <σ*2py.
Полуразность числа электронов на связывающих (Nсв) и разрыхляющих (Nр) орбиталях носит название порядка(кратности) связи n:
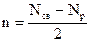 .
.
Молекула образуется, если n>0, т.е. связь может быть образована не только парой, но и одним электроном, и, следовательно, порядок связи может быть не только целым, но и дробным числом. С увеличением порядка возрастает энергия связи.
Двухатомные гомоядерные молекулы элементов 1-го периода. Простейшей молекулой является молекулярный ион 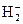 . В соответствии с принципом наименьшей энергии единственный электрон молекулы располагается на σ1s МО. Следовательно, электронная формула молекулярного иона
. В соответствии с принципом наименьшей энергии единственный электрон молекулы располагается на σ1s МО. Следовательно, электронная формула молекулярного иона 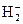 запишется как
запишется как
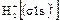 .
.
Электронная формула может быть представлена графически в виде молекулярной (энергетической) диаграммы(рис. 6.12), показывающей относительные энергии атомных и молекулярных диаграмм и число электронов на них.
Порядок связи иона 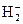 n=(1-0)/2=0,5, следовательно, эта частица может существовать.
n=(1-0)/2=0,5, следовательно, эта частица может существовать.
|
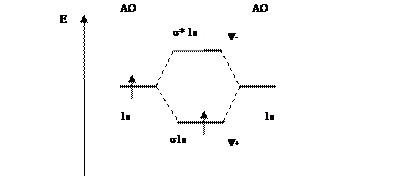
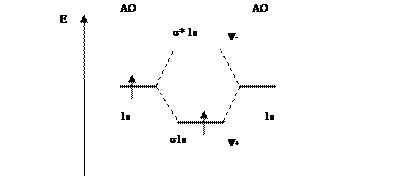
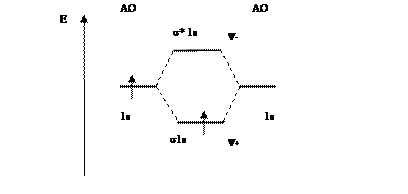
Рис. 6.12. Молекулярная диаграмма 
Молекулярный ион  имеет один электрон, поэтому он является парамагнитным, т.е. втягивается в магнитное поле. Все вещества, имеющие неспаренные электроны, относятся к парамагнетикам.
имеет один электрон, поэтому он является парамагнитным, т.е. втягивается в магнитное поле. Все вещества, имеющие неспаренные электроны, относятся к парамагнетикам.
Молекула водорода Н2 содержит два электрона, и ее электронная формула имеет следующий вид:
Н2[(σ1s)2 ].
Из молекулярной диаграммы (рис. 6.13) следует, что порядок связи молекулы водорода равен единице. Увеличение порядка связи от 0,5 до 1 при переходе от  к Н2 сопровождается увеличением энергии связи от 236 до 436 кДж/моль и уменьшением длины связи от 0,106 до 0,074 нм.
к Н2 сопровождается увеличением энергии связи от 236 до 436 кДж/моль и уменьшением длины связи от 0,106 до 0,074 нм.
Электроны молекулы Н2 спарены, и по этой причине молекулярный водород диамагнитен, т.е. выталкивается из магнитного поля. К диамагнетикам относятся все вещества, не содержащие неспаренных электронов.
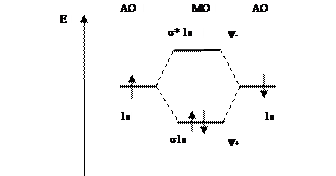
Рис.6.13. Молекулярная диаграмма Н2
Второй элемент 1-го периода гелий в соответствии с представлениями метода МО может образовывать парамагнитный молекулярный ион 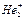 (n=0,5), а молекула Не2 существовать не может, т.к. число электронов на связывающей и разрыхляющей молекулярных орбиталях одинаково и порядок связи равен нулю.
(n=0,5), а молекула Не2 существовать не может, т.к. число электронов на связывающей и разрыхляющей молекулярных орбиталях одинаково и порядок связи равен нулю.
Двухатомные гомоядерные молекулы элементов 2-го периода. Рассмотрим в качестве примера молекулу кислорода. Двенадцать электронов внешних уровней двух атомов кислорода (2s22p4) заполнят молекулярные орбитали следующим образом:
О2 [KK(σ2s)2 (σ*2s)2 (σ2py)2 (π2px)2=( π2pz)2 (π*2px)1 =(π*2px )1].
Cимвол К в электронной формуле означает, что электроны К-уровня (1s2) не участвуют в образовании молекулярных орбиталей. Молекулярная диаграмма молекулы кислорода представлена на рис. 6.14. В соответствии с правилом Гунда два электрона на орбиталях π2px и π2pz являются неспаренными и молекула кислорода является парамагнитной, что подтверждено экспериментально. Отметим, что в рамках метода валентных связей невозможно объяснить парамагнетизм кислорода. Порядок связи в молекуле О2 n=(8-4)/2=2.
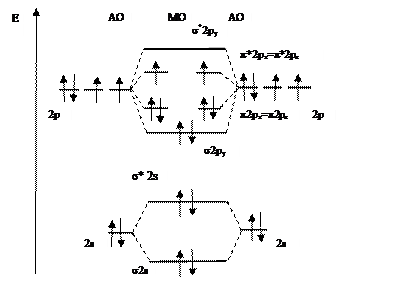
Рис. 6.14. Молекулярная диаграмма О2
Порядок связи в двухатомных гомоядерных молекулах элементов 2-го периода увеличивается от 1 у В2 до 3 у N2, а затем уменьшается до 1 у F2. Образование молекул Be2 и Ne2 невозможно, т.к. порядок связи в этих молекулах равен нулю.
Двухатомные гетероядерные молекулы элементов 2-го периода. Атомные орбитали различных атомов вносят различный вклад в молекулярные орбитали, или, что то же самое, коэффициенты сi в уравнениях
ψ+ = с1ψА + с2ψВ;
ψ- = с3ψА – с4ψВ
не равны единице. В связывающую орбиталь больший вклад вносит атомная орбиталь более электроотрицательного элемента, а разрыхляющую – АО более электроположительного элемента. Если атом В более электроотрицателен, чем атом А, то с2>с1, а с3>с4. Связывающие МО по энергии ближе к АО более электроотрицательного атома, а разрыхляющие – к АО более электроположительного атома.
В качестве примера приведем молекулу СО. Десять электронов атомов углерода и кислорода разместятся по МО следующим образом:
СО [KK (σ2s)2 (σ*2s)2 (π2px)2=(π2pz)2(σ2py)2].
Порядок связи в молекуле СО n=(8-2)/2=3. Молекула СО парамагнитна. Молекулярная диаграмма приведена на рис. 6.15.
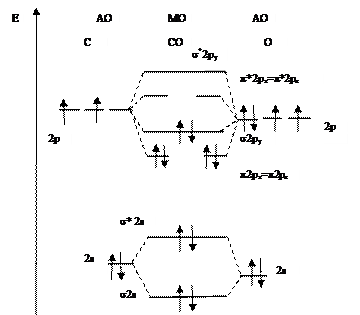
Рис. 6.15. Молекулярная диаграмма СО
Металлическая связь
Рабочая программа. Металлическая связь. Энергетическая зона, валентная зона, зона проводимости, запрещённая зона. Проводники, полупроводники, изоляторы.
Металлы, составляющие большую часть периодической системы Д.И. Менделеева, обладают рядом особенностей:
1) металлическим блеском, т.е. высокой отражательной способностью к свету;
2) высокими тепло- и электропроводностями;
3) пластичностью и ковкостью.
Эти свойства металлов объясняются особым типом ковалентной связи, называемым металлической связью.
С позиций метода молекулярных орбиталей кристалл металла представляет собой одну огромную молекулу. Атомные орбитали атома перекрываются с атомными орбиталями соседних атомов, образуя связывающие и разрыхляющие МО. Эти
орбитали перекрываются, в свою очередь, с атомными орбиталями следующих соседей и т.д.
В результате происходит перекрывание атомных орбиталей всех атомов, составляющих кристалл металла, и образуется огромное число МО, распространяющихся на весь кристалл (рис. 6.16).
Металлы имеют высокие координационные числа, обычно 8 или 12, т.е. каждый атом окружен 8 или 12 соседями. Например, координационое число лития – 8. Следовательно, 2s-атомная орбиталь лития перекрывается с 2s-атомными орбиталями восьми соседних атомов, а те, в свою очередь, перекрыва- ются с атомными орбиталями своих соседей и т.д. В 1 моль ли-
тия происходит перекрывание 6,02.1023 атомных орбиталей с образованием такого же количества молекулярных орбиталей. Различие в энергиях этих орбиталей очень мало и составляет величину порядка 10-22 эВ (10-21 кДж). Молекулярные орбитали образуют энергетическую зону. Заполнение энергетической зоны электронами происходит в соответствии с правилами
наименьшей энергии, правилом Гунда и запретом Паули. Следовательно, максимальное количество электронов в энергетической зоне, образованной s-электронами, составит 2N, где N – число атомов в кристалле. Соответственно, в зонах, образованных p-, d- и f-орбиталями, может находиться до 6N, 10N или 14N электронов.
 |
Рис. 6.16. Схема образования энергетической зоны
Зона, заполненная электронами, осуществляющими химическую связь, называется валентной зоной. Эта зона может быть заполнена в различной степени, в зависимости от природы металла, его строения и т.д. Выше валентной зоны располагается свободная зона, называемая зоной проводимости. В зависимости от природы атомов и строения кристаллической решетки валентная зона и зона проводимости могут перекрываться или быть отделенными энергетическим разрывом, называемым запрещенной зоной. В случае перекрывания валентной зоны и зоны проводимости вещества относятся к металлам. Если ширина запрещенной зоны составляет ΔЕ=0,1÷3,0 эВ, то вещества относятся к полупроводникам, если ΔЕ>3 эВ – то к изоляторам.
Валентная зона металлов обычно заполнена электронами неполностью. Поэтому перевод электронов в зону проводимости требует очень малой затраты энергии, что и объясняет высокие электро- и теплопроводность металлов.
Межмолекулярная связь
Рабочая программа. Межмолекулярная связь. Силы Ван-дер-Ваальса: ориентационные, индукционные, дисперсионные. Водородная связь. Влияние на физико-химические свойства веществ.
Между электронейтральными атомами и молекулами в твердом, жидком и газообразном состояниях всегда действуют силы притяжения. Об этом свидетельствуют, например, неидеальность реальных газов, понижение температуры газов при расширении, существование благородных газов в конденсированном состоянии и др.
Различают два типа межмолекулярных взаимодействий:
1) силы Ван-дер-Ваальса;
2) водородная связь.
Иногда к межмолекулярным взаимодействиям относят донорно-акцепторную и металлическую связь.
Силы Ван-дер-Ваальса. Основными свойствами сил Ван-дер-Ваальса являются невысокая энергия (до ~40 кДж/моль) и ненасыщаемость. Различают три типа сил Ван-дер-Ваальса: ориентационные, индукционные и дисперсионные.
Ориентационное (диполь-дипольное) взаимодействиеимеет место только между полярными молекулами. При достаточно малых расстояниях между молекулами противоположно заряженные концы диполей притягиваются, а одноименно заряженные – отталкиваются (рис. 6.17,а) Чем больше дипольные моменты молекул, тем сильнее ориентационное взаимодействие. Ориентационное взаимодействие ослабляется при увеличении температуры и расстояния между молекулами.
Индукционное взаимодействиеосуществляется между молекулами разной полярности. Под действием электрического поля более полярной молекулы неполярная или малополярная молекула поляризуется, т.е. в ней возникает (индуцируется) диполь или увеличивается дипольный момент (рис. 6.17,б). Энергия индукционного взаимодействия определяется величиной дипольного момента полярной молекулы, расстоянием между молекулами и поляризуемостью неполярной молекулы, т.е. ее способностью к образованию диполя под действием внешнего поля.
Дисперсионное взаимодействие является наиболее универсальным, т.е. действует между любыми молекулами независимо от их полярности. Ядро атома и электрон образуют мгновенные диполи, индуцирующие мгновенные диполи у соседних частиц (рис. 6.17,в). Синхронное движение мгновенных диполей разных молекул ведет к понижению энергии системы и притяжению частиц. Энергия дисперсионного взаимодействия увеличивается с ростом поляризуемости частиц, уменьшением расстояния между ними и не зависит от температуры.
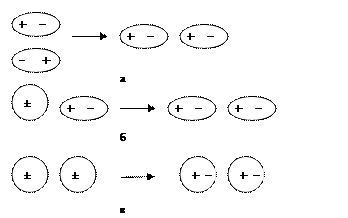
Рис. 6.17. Вандерваальсовы взаимодействия: а – ориентационное; б – индукционное; в – дисперсионное
Энергия вандерваальсовых взаимодействий обратно пропорциональна шестой степени расстояния между центрами взаимодействующих частиц. При сильном сближении молекул начинают действовать силы отталкивания между электронными оболочками, которые уравновешивают силы притяжения.
Относительные величины различных типов вандерваальсова взаимодействия для некоторых веществ приведены в табл. 6.1.
Таблица 6.1. Вклад отдельных составляющих в энергию вандерваальсова взаимодействия
| Вещество | Дипольный момент D | Поляризуемость, м3.1030 | Энергия взаимодействия, кДж/моль | ||
| Еор | Еинд | Едисп | |||
| Н2 Хе HI NН3 | 0,38 1,52 | 0,8 4,16 5,42 2,23 | 0,6 13,3 | 0,3 1,5 | 0,17 18,4 60,6 14,7 |
Из табл. 6.1 следует, что увеличение дипольного момента ведет к росту ориентационного и индукционного взаимодействий, а увеличение поляризуемости сопровождается усилением дисперсионного взаимодействия.
Водородная связьявляется особым типом межмолекулярного взаимодействия, который имеет место между молекулами соединений, содержащих группировки F-H, O-H, N-H, т.е. атом водорода и элемент с очень высокой электроотрицательностью.
Электронная плотность связи Э-Н смещена в сторону электроотрицательного элемента. Атом водорода теряет электронную оболочку и превращается в протон. Благодаря своим малым размерам и отсутствию отталкивания электронных оболочек, протон способен вступать в электростатическое взаимодействие с электронной оболочкой сильно электроотрицательного атома соседней молекулы. Одновременно водород выступает в роли акцептора электронной пары, предоставляемой электроотрицательным атомом соседней молекулы.
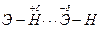 .
.
Силы Ван-дер-Ваальса и отталкивания также вносят вклад в образование водородной связи.
В отличие от сил Ван-дер-Ваальса водородная связь обладает свойствами направленности и насыщаемости.
Энергия водородной связи невелика, составляет от 8 до 40 кДж/моль и возрастает в ряду N-H < O-H < F-H. Тем не менее наличие водородной связи оказывает сильное влияние на физико-химические свойства веществ. Так, молекула воды может участвовать в образовании четырех водородных связей. Это ведет к образованию прочных ассоциатов (Н2О)n, что объясняет высокую температуру плавления и кипения воды по сравнению с ее аналогом – H2S (tкип=-61,8 оС), высокую теплоёмкость (4,218 кДж/кг•К при температуре 273К), высокую энтальпию испарения (2250 кДж/кг). Сероводород как соединение с более высокой молекулярной массой должен был бы иметь более высокую температуру кипения, чем вода. Отсутствие сильных водородных связей у H2S приводит к обратной зависимости.
Водородная связь объясняет образование ассоциатов фторида водорода (HF)n, димеризацию карбоновых кислот:
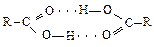
Очень многие химические соединения содержат химические связи N-H и O-H, следовательно, водородные связи встречаются очень часто. Особо важную роль водородные связи играют для биологических объектов. Так, двойные спирали ДНК соединяются межмолекулярными водородными связями.
Вопросы для самостоятельной подготовки
1.Рассмотрите образование ковалентной связи на примере молекулы водорода. Приведите график зависимости потенциальной энергии системы из двух атомов водорода от межъядерного расстояния.
2. Как объяснить большую устойчивость молекулы F2 по сравнению с системой из двух свободных атомов фтора?
3.Приведите электронные структуры атомов элементов 2-го периода в основном и возбужденном состояниях.
4. Почему атом аргона не образует химических связей?
5. Почему атом кислорода образует 2 химические связи, а атом серы – 6?
6. Гибридизация атомных орбиталей. Факторы, благоприятствующие гибридизации. Ориентация гибридных орбиталей в пространстве. sp-, sp2-, sp3- и sp3d2 - гибридизация.
7. Приведите примеры влияния несвязывающих (неподелённых) электронных пар на стереохимию молекул.
8. Как влияет положение элемента в ПСЭМ на устойчивость гибридизации атомных орбиталей? Приведите примеры.
9. Определите тип гибридизации орбиталей центрального атома в ионе гидроксония Н3О+. Изобразите геометрическую форму этой частицы.
10. В чём особенности донорно-акцепторного механизма образования ковалентной связи? Приведите примеры частиц, способных играть роль донора и акцептора электронной пары.
11. Какие факторы влияют на энергию химической связи?
12. Расположите следующие соединения в порядке возрастания длины связи: NaH, NaF, NaCl, NaBr.
13. Расположите следующие связи в порядке увеличения их энергии: а) О-О; О=О; б)О-О; S-S; в)Н-F; H-Cl; H-Br; г)Li-H; Be-H; B-H; C-H.
14. Какая из связей прочнее: а) C-F или C-Br; б) C=O или С-О; в) O=O или S=S?
15. В каких из следующих соединений связь центрального атома является насыщенной: а) IF3; IF5; IF7; б)Cl2O; ClO2; Cl2O7?
16. Определите координационное число атома алюминия в соединениях: а) Li[AlH4]; б) Na3[AlF6].
17. Расположите следующие химические связи в порядке увеличения полярности: Na-O; Na-F; Na-N.
18. Какая из молекул HF, HCl, HBr, HI имеет наибольшую длину диполя?
19. Как изменяется полярность связи в ряду HF, HCl, HBr, HI?
20. Какие факторы влияют на величину дипольного момента следующих молекул: а) NH3, б) РН3, в) AsH3? Какая из этих молекул может иметь наибольший дипольный момент?
21. Какой тип связи реализуется в следующих молекулах: HCl, Cl2, RbСl, ClF?
22. Расположите следующие ионы в порядке уменьшения их поляризующей способности: Na+; Mg2+; Al3+.
23. Расположите следующие ионы в порядке увеличения их поляризуемости:F-; Cl-; Br -;I-.
24. В водном растворе какой соли связь О-Н в молекуле воды будет поляризована в большей степени: NaCl; MgCl2; AlCl3? Почему?
25. В чем причина роста силы галогенводородных кислот, наблюдающегося при увеличении порядкового номера атома галогена?
26. В чем причина увеличения силы гидроксидов щелочных и щелочноземельных элементов, наблюдающегося при увеличении заряда ядра атомов металла?
27. Почему серная кислота сильнее сернистой?
28. Почему уксусная кислота СН3СООН намного слабее трифторуксусной кислоты СF3СООН?
29. Определите сколько σ- и π-связей содержит молекула бутадиена CH2CHCHCH2?
Ответ: 9 σ- и 2 π-связи.
30. Определите сколько σ- и π-связей содержит молекула винилацетилена CHCCHCH2?
Ответ: 7 σ- и 3 π-связи.
31. Изложите основные положения метода молекулярных орбиталей.
32. В чём состоит основное отличие метода МО от метода ВС?
33. Составьте электронную формулу и приведите молекулярную диаграмму молекулы азота. Определите порядок связи и укажите магнитные характеристики молекулы.
34. Составьте электронную формулу и приведите молекулярную диаграмму молекулы фтора. Определите порядок связи и укажите магнитные характеристики молекулы.
35. Составьте электронную формулу и приведите молекулярную диаграмму молекулы оксида азота (II). Определите порядок связи и укажите магнитные характеристики молекулы.
36. Объясните с позиций метода молекулярных орбиталей увеличение энергии связи в ряду фтор, кислород, азот.
37. Как изменится энергия химической связи при переходе от F2 к 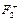 и
и 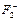 ?
?
38. Какая из перечисленных молекул не должна существовать: а) С2, б) Li2, в) Ве2, г) В2?
39. Какие физические свойства характерны для металлов?
40. Опишите особенности химической связи в металлах и её характеристики.
41. В чём причины различия электропроводностей металлов, полупроводников и изоляторов?
42. Приведите примеры физических явлений, указывающих на наличие взаимодействий между нейтральными атомами и молекулами.
43. Опишите механизм возникновения и характеристики вандерваальсовых взаимодействий.
44. Какие типы вандерваальсовых взаимодействий могут иметь место для следующих веществ: гелия, метана, азота, бромистого водорода?
45. Какой тип сил Ван-дер-Ваальса преобладает в каждом из следующих веществ: O2, H2O, OF2?
46. Опишите взаимодействия, вносящие свой вклад в образование водородной связи.
47. Какой тип связи реализуется при образовании иона Н3О+ из протона и молекулы воды?
48. Для каких из следующих соединений возможны водородные связи: SiH4, HCOOH, CH3CH(NH2)COOH, H2O2, HCl?
49. Почему температура кипения аммиака NH3 выше, чем у фосфина PH3?
50. Почему одноосновная фтористоводородная кислота может образовывать кислые соли, например NaHF2, а соляная кислота аналогичные соединения не образует?
6.6. Задания для текущих и промежуточных контролей
1. Объясните термин «перекрывание атомных орбиталей».
2. Можно ли сказать, что благородные газы He, Ne и другие состоят из молекул?
3. Почему хлорводородная кислота сильнее фторводородной?
4. Что является причиной образования любой химической связи? Каким энергетическим эффектом сопровождается этот процесс?
5. Как изменяется прочность связи в ряду HF, HCl, HBr, HI? Укажите причины этих изменений.
6. Предскажите, какая из связей прочнее: а) С – F или C – Br; б) С = О или С – О; в) О – О или S – S.
7. Расположите следующие связи в порядке увеличения полярности: Na – O, Na – F, Na – N.
8. Расположите указанные связи в порядке возрастания полярности: а) H – F, H – C, H – H; б) P – S, Si – Cl, Al – Cl.
9. Как называется расстояние между центрами ядер атомов в молекуле и каким образом оно влияет на прочность химических связей?
10. Почему и как влияет размер атомов на длину и энергию образующейся между ними связи?
11. Чем объясняется большая устойчивость системы из двух связанных атомов (например, Н2) по сравнению с системой из двух свободных атомов (2Н)?
12. Чем объясняется способность атомов многих элементов к образованию числа связей, превышающих число неспаренных электронов в их атомах в основном состоянии?
13. Укажите факторы, способствующие гибридизации атомных орбиталей.
14. Объясните, каким образом атом углерода, имеющий два неспаренных электрона, может проявлять ковалентность, равную четырем?
15. Сравните механизм образования ковалентных связей в молекулах СН4, NH3 и в ионе 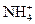 .
.
16. Приведите схему перекрывания атомных орбиталей в молекулах BeCl2 и BF3.
17. Какая из молекул HF, HCl, HBr или HI имеет наибольшую длину диполя?
18. Расположите указанные связи в порядке возрастания полярности:
а) H – F, F – C, F – F;
б) C – N, B – O, Li – l;
в) P – S, Si – Cl, Al – Cl
19. Расположите в порядке возрастания степени ионности связи В – Cl, Na – Cl, Ca – Cl, Be – Cl.
20. Для каких связей длина диполя а) равна нулю; б) меньше длины связей; в) равна длине связей?
21. Укажите донор и акцептор в реакции Н2О + Н+ = Н3О+.
22. Какая из следующих молекул должна иметь наибольший дипольный момент: NH3, PH3, AsH3, BH3?
23. Какая связь называется водородной? Как она влияет на физические свойства веществ?
24. Рассмотрите с позиций метода МО частицу 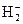 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
25. Рассмотрите с позиций метода МО частицу 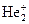 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
26. Рассмотрите с позиций метода МО частицу 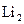 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
27. Рассмотрите с позиций метода МО частицу 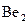 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
28. Рассмотрите с позиций метода МО частицу 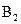 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
29. Рассмотрите с позиций метода МО молекулу 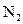 . Каков порядок связи и магнитные свойства этой молекулы?
. Каков порядок связи и магнитные свойства этой молекулы?
30. Рассмотрите с позиций метода МО молекулу 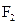 . Каков порядок связи и магнитные свойства этой молекулы?
. Каков порядок связи и магнитные свойства этой молекулы?
Библиографический список
1.Пирогов, А.И. Общая химия: учеб. пособие /А.И. Пирогов; Иван. гос. энерг. ун-т. – Иваново,2010. – 220 с.
2.Пирогов, А.И., Общая химия: учеб.-метод. программированное пособие/А.И. Пирогов,А.В. Ионов; Иван. гос. энерг. ун-т. – Иваново,2012. – 76 с.
3.Пакет заданий по текущим и промежуточным контролям: метод. разработка для студентов I курса / И.М. Арефьев [и др.] ; под ред. А.И. Пирогова; Иван. гос. энерг. ун-т. – Иваново, 2011. – 72 с.
4.Методическиеуказания к выполнению лабораторных работ по общей химии/ В.К. Абросимов [и др.]; под ред. В.К. Абросимова; Иван. гос. энерг. ун-т. – Иваново, 2000. – 44 с.
5.Коровин, Н.В. Общая химия (бакалавриат)/ Н.В. Коровин. – 13-е изд. – М.: Академия, 2011. – 496 с.
6. Задачи и упражнения по общей химии: учеб. пособие / Б.И. Адамсон [и др.] ; под ред. Н.В. Коровина. – 3-е изд. – М.: Высш. шк., 2006. – 255 с.
7.Коровин, Н.В. Лабораторные работы по химии: учеб. пособие для вузов/Н. В. Коровин [и др.] – 4-е изд.– М.: Высш. шк., 2007 – 256 с.
8.Глинка, Н.Л.Общая химия: учеб. для бакалавров / Н.Л. Глинка; под. ред. В.А. Попкова, А.В. Бабкова. – 19-е изд., перераб. и доп. – М.: Юрайт, 2014. – 900 с. – (Серия «Бакалавр. Базовый курс»).
9.Глинка, Н.Л.Задачи и упражнения по общей химии: учеб.-практ. пособие для бакалавров / Н.Л. Глинка; под. ред. В.А.Попкова, А.В. Бабкова. – 14-е изд. – М.: Юрайт, 2014. – 236 с. – (Серия «Бакалавр. Базовый курс»).
10.Глинка, Н.Л.Практикум по общей химии: учеб. пособие для академ. бакаравриата / Н.Л. Глинка; под. ред. В.А. Попкова, А.В. Бабкова, О.В. Нестеровой. – М.: Юрайт, 2014. – 248 с. – (Серия «Бакалавр. Академический курс»).
11.Степин, Б.Д. Применение международной системы единиц физических величин в химии / Б.Д. Степин. – М.: Высш. шк., 1990. – 96 с.
12.Сборникзадач и упражнений по общей химии: учеб. пособие для вузов / Л.М. Романцева [и др.]. – 2-е изд. – М.: Высш. шк., 1991. – 288 с.
13.Пирогов, А.И.Сборник задач и примеров по курсу «Теоретические основы химико-технологических процессов (ионные равновесия в растворах)» / А.И. Пирогов; Иван. гос. энерг. ун-т. – Иваново, 2006. – 55 с.
14.Краткийсправочник физико-химических величин / под ред. А.А. Равделя и А.М. Пономарёвой. – Л.: Химия, 1983 – 200 с.
Приложения
Приложение 1
