Конфигурации атомов в основном и возбужденном состоянии.
Атомы многих элементов могут увеличивать свою валентность (число неспаренных электронов) в результате перехода из основного состояния в возбужденное состояние.
Возбужденное состояние атома – это состояние с более высокой энергией, чем основное.
Процесс перехода атома из основного в возбужденное состояние называется возбуждением атома.
В процессе возбуждения атома происходит разъединение спаренных электронов в переход одного из них с данного подуровня на свободную орбиталь другого подуровня в пределах одного энергетического уровня.
Например, атом углерода в основном состоянии является двухвалентным, т.к. из четырех электронов внешнего электронного слоя только два являются непареными:
↑ ↑ → свободная орбиталь
6С ↑↓
2s 2p
При поглощении энергии Е один из электронов 2s-подуровня переходит на свободную орбиталь 2р-подуровня, в результате чего образуется 4 неспаренных электрона:
+E
↑ ↑ → ↑ ↑ ↑
↑↓ ↑ 2p
2s 2p 2s
2s12p3
В возбужденном состоянии углерод является четырехвалентным. Такую валентность углерод проявляет в большинстве соединений.
Энергия возбуждения атома компенсируется энергией образования новых химических связей.
Возбуждение атомов возможно не для всех элементов.
Например, атомы кислорода и серы имеют одинаковую конфигурацию внешнего электронного слоя: s2p4, потому что и кислород, и сера находятся в главной подгруппе VI группы. В основном (невозбужденном) состоянии атомы кислорода и серы имеют по 2 неспаренных электрона на внешнем электронном слое:
8О ↑↓ ↑ ↑ 16S
↑↓ ↑↓ ↑ ↑
2s 2p ↑↓ 3p 3d
3s
Атом кислорода атом серы
Поэтому, в основном состоянии кислород и сера имеют одинаковую валентность, равную двум. Но атом серы может перейти в возбужденное состояние за счет перехода электронов с 3s- и 3p-подуровней на основные орбитали d-подуровня:
+E
S →
↑↓ ↑ ↑
↑↓ 3d
3s 3p основное состояние
Валентность II
S*
↑ +E
→ ↑ ↑ ↑ →
↑↓ 3d
3s 3p
Валентность IV
Возбужденные состояния
↑ ↑
→ ↑ ↑ ↑
↑ 3d
3s 3p
Валентность VI
Это является причиной переменной валентности серы.
Например:
H2S – валентность серы равна II (H – S – H)
SO2 – валентность серы равна IV (O = S = O)
SO3 – валентность серы равна VI (О = S = O)
||
O
Атом кислорода не может перейти в возбужденное состояние, потому что на втором энергетическом уровне отсутствует d-подуровень, т. е. нет свободных орбиталей, на которые могут переходить электроны. Это является причиной постоянной валентности кислорода во всех соединениях.
Выводы:
1. Атомы многих элементов могут увеличивать свою валентность (число неспаренных электронов) в результате перехода из основного состояния в возбужденное состояние.
2. Процесс перехода атома из основного в возбужденное состояние называется возбуждением атома.
3. Энергия возбуждения атома компенсируется энергией образования новых химических связей.
4.Возбуждение атомов возможно не для всех элементов.
ВОПРОСЫ ДЛЯ самоконтроля:
1. Что называется атомом?
2. Из чего состоит атом?
3. Из чего состоит ядро атома?
4. Что называется протоном?
5. Что называется нейтроном?
6. Какой заряд имеет атом и почему?
7. Какой заряд имеет электрон?
8. Чему равна атомная масса элемента?
9. Как определяется количество протонов, электронов, нейтронов в атоме элемента?
10. Что показывает главное квантовое число?
11. Что показывает орбитальное квантовое число?
12. Что показывает магнитное квантовое число?
13. Что показывает спиновое квантовое число?
14. В чем заключается принцип Паули?
15. В чем заключается принцип наименьшей энергии?
16. В чем заключается правило Гунда?
17. Что называется электронным облаком?
18. Какие электроны называются спаренными?
19. Чему равно максимальное число электронов на энергетическом уровне?
20. Что такое изотопы?
21. Что называется химическим элементом?
22. Объясните физический смысл порядкового номера химических элементов в периодической системе.
23. Отличаются ли изотопы одного и того же элемента числом электронов в атоме? Почему?
24. В чем заключается двойственная природа электрона?
25. Почему электрон на атомной орбитали рассматривают как электронное облако?
26. Как отличаются между собой s- и p-орбитали
27. .Определите по электронной формуле местоположение в ПСХЭ элемента №15.
Тестовые задания для самоконтроля
1. Число нейтронов в атоме 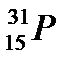 равно:
равно:
А. 31
Б. 15
В. 46
Г. 16
2. Число орбиталей на р – подуровне равно:
А. 2
Б. 3
В. 1
Г. 5
Д. 7
3. Максимальное число электронов на s – подуровне равно:
А. 6
Б. 10
В. 2
Г. 14
Д. 1
4. Подуровень, для которого n = 3u l = 1 обозначается:
А. 1s
Б. 3s
В. 3p
Г. 3d
5. Назовите элемент, если его электронная формула 1s22s22p63s23p4:
А. 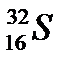
Б. 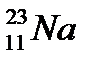
В. 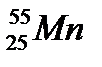
Г. 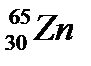
6. Число электронов в атоме 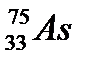 равно:
равно:
А. 75
Б. 42
В. 108
Г. 33
7. Атомный номер элемента показывает:
А. число элементарных частиц в атоме
Б. число нуклонов в атоме
В. число нейтронов в атоме
Г. число протонов в атоме
8. Заряд атома железа равен:
А. +8
Б. +56
В. +26
Г. +16
9. Общее число электронов у иона Mn2+:
А. 23
Б. 25
В. 27
Г. 55
10.Ядро атома 4019 К содержит :
А. 19р и 19n
Б. 40р и 19n
В. 19n и 40р
Г. 19р и 21n
11. Число неспаренных электронов у атома сурьмы равно:
А. одному
Б. трем
В. пяти
Г. семи
12. Электронную конфигурацию, идентичную конфигурации атома аргона, имеет ион :
А. Na+
Б. Cu2+
В. S2-
Г. F-
13. Число неспаренных электронов в атоме хрома в невозбужденном состоянии равно:
А. 1
Б. 4
В. 5
Г. 6
14. Атому фосфора в возбужденном состоянии будет соответствовать электронная конфигурация внешнего энергетического уровня :
А. 3s2 3p3
Б. 3s1 3p33d1
В. 3s1 3p23d2
Г. 3s1 3p13d3
15. Валентные возможности атома хлора в нормальном и возбужденных состояниях соответствуют ряду чисел :
А. 1, 2, 3, 4
Б. 1, 2, 5, 7
В. 1, 3, 5, 7
Г. 3, 4, 5, 7
16. Распределение электронов по энергетическим уровням соответствует ряду чисел :
А. 2, 8, 12, 1
Б. 2, 8, 13, 0
В. 2, 8, 11, 2
Г. 2, 8, 10, 3
17. Число d- электронов у иона Cu2+ равно :
А. 6
Б. 8
В. 9
Г. 10
18. Число d – электронов у атома серы в максимально возбужденном состоянии равно :
А. 1
Б. 2
В. 4
Г. 6
19. Атомы серы в нормальном состоянии и атом хрома в максимально возбужденном состоянии имеют соответственно конфигурации валентных электронов :
А. 3s2 3p4 и 3d54s1
Б. 3s2 3p33d1 и 3d44s2
В. 3s2 3p23d2 и 3d54s1
Г. 3s2 3p4 и 3d44s2
