Электронные конфигурации многоэлектронных атомов
Под термином электронная конфигурация атома подразумевается распределение электронов по различным квантовым состояниям (расположение их на разных орбиталях). Принцип построения электронных конфигураций многоэлектронных атомов (заполнение электронами энергетических состояний) состоит в последовательном добавлении протона и электрона к атому водорода при выполнении следующих условий
1. Принцип минимума энергии электронов. Наиболее стабильное состояние атома соответствует наименьшей энергии электронов. То есть в атоме, находящемся в стационарном состоянии, электроны должны располагаться на таких орбиталях, чтобы их суммарная энергия была минимальной.
2. Принцип (запрет) Паули (Pauli). В атоме не может быть двух электронов, состояние которых описывается одинаковым набором квантовых чисел. То есть на одной орбитали может находиться не более двух электронов с различными значениями спиновых квантовых чисел. Это значит, что для одного значения главного квантового числа n s-электронов – 2 (одна s-орбиталь), p-электронов – 6 (3 p-орбитали), d-электронов – 10 (5 d-орбиталей), f-электронов – 14 (7 f-орбиталей).
3. Правило Хунда(Hund). При выполнении первых двух правил электроны располагаются на орбиталях таким образом, чтобы суммарное значение спиновых квантовых чисел было максимальным.
Энергетическое состояние обозначают при помощи цифр и букв. Цифра показывает значение главного квантового числа, буква – орбитального квантового числа (тип орбитали). Надстрочный индекс показывает число электронов, находящихся на данных орбиталях. Например, 5р3 обозначает, что на орбиталях с n=5 и l=1 находятся три электрона.
Графически при составлении энергетических диаграмм или их фрагментов орбитали изображаются в виде черточек или прямоугольников, а электроны, занимающие эти орбитали, в виде стрелок, направление которых соответствует тому или иному значению спинового квантового числа.
Основное состояние атома водорода (H) обозначается 1s1, один электрон занимает минимальную по энергии орбиталь. Спин электрона может принимать произвольное значение (при большом числе атомов водорода в свободном пространстве вероятности нахождения электрона в состоянии сms = ±1/2 равны, поэтому половина атомов водорода имеют ms=+1/2, а другая половина ms=–1/2). Атом водорода является парамагнитным (парамагнетизм обусловлен наличием у атомов или ионов собственного магнитного момента, связанного с ненулевым значением суммарного спина электронов Sms¹0).
Следующий атом в порядке возрастания атомного номера – гелий (He) – имеет два электрона. На минимальной по энергии 1s-орбитали, не нарушая запрет Паули, можно разместить и второй электрон, если спины электронов будут противоположны, говорят спарены. Наборы квантовых чисел, описывающие электроны атома гелия, будут различаться только спинами. Электронная конфигурация атома гелия 1s2. Поскольку электроны спарены, то суммарный спин равен нулю, атом гелия не является парамагнитным.
Конфигурация 1s2 соответствует состоянию с полностью занятыми орбиталями, для которых n=1. Говорят, заполнен первый электронный слой (энергетический уровень), понимая под электронным слоем набор орбиталей с одинаковым значением главного квантового числа.
При переходе к атому лития (Li), имеющему три электрона, первые два электрона размещаются так же, как у гелия (1s2), а третий занимает следующую минимальную по энергии 2s-орбиталь. Электронная конфигурация атома лития 1s22s1. Следующий атом бериллия (Be), у которого четыре электрона, имеет конфигурацию1s22s2. Атом Li имеет один неспаренный электрон, а у атома Be все электроны спарены. Конфигурация 2s2 соответствует состоянию с полностью занятыми s-орбиталями, для которых n=2. Поскольку для n=2 существуют и p-орбитали, то говорят, что заполнен первый энергетический подуровень второго электронного слоя.
Атом бора (B) имеет пять электронов, четыре из которых располагаются на орбиталях, соответствующих конфигурации предыдущего атома Be, а пятый занимает одну (любую) из трех 2p-орбиталей, которые имеют одинаковую минимальную энергию. Электронная конфигурация атома бора 1s22s22p1. Электронные конфигурации последующих пяти атомов от углерода (C) до неона (Ne) будут аналогичными, каждый последующий электрон будет занимать 2p-орбитали. Поскольку 2p-орбиталей у атома три, а на каждой орбитали могут разместиться два электрона с противоположными спинами, то атомов с электронной конфигурацией 1s22s22px будет шесть: от 1s22s22p1 – у бора, до 1s22s22p6 – у неона, электронная конфигурация которого соответствует состоянию с полностью заполненными орбиталями первого (n=1) и второго (n=2) электронного слоя.
Продолжив заполнение орбиталей, можно получить последовательность электронных конфигураций многоэлектронных атомов в зависимости от заряда ядра (первые пять периодов), приведенную на рис. 1.19 (с.42).
В случае если число электронов, располагающихся на энергетически эквивалентных орбиталях, меньше, чем число орбиталей, то более устойчивой конфигурацией будет состояние, когда электроны занимают различные орбитали и спины электронов будут одинаковы (правило Хунда). В данном состоянии взаимодействие электронов друг с другом минимально, что энергетически выгодно.
Пример. Углерод (С) – электронная конфигурация 1s22s22p2.
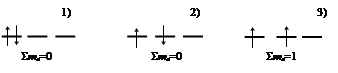 Два электрона, занимающие 2p-орбитали, не противореча принципу Паули, могут располагаться следующим образом:
Два электрона, занимающие 2p-орбитали, не противореча принципу Паули, могут располагаться следующим образом:
Наиболее устойчивым состоянием, согласно правилу Хунда, будет состояние 3, поскольку суммарное значение спиновых квантовых чисел максимально. Атом углерода имеет неспаренные электроны, т.е. парамагнитен.
Некоторые исключения наблюдаются при заполнении электронами энергетических состояний, мало отличающихся друг от друга по энергии. Для орбиталей, имеющих одинаковые значение орбитального квантового числа l, наиболее выгодными являются наполовину или полностью заполненные структуры.
Пример. Хром (Cr) [Ar]4s13d 5 (а не [Ar]4s23d 4),
медь (Сu) ) [Ar]4s13d 10 (а не [Ar]4s23d 9)
| 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | 5p | ||||
| | | | ¯ | ¯¯ | ¯¯¯ | |||||
| 4d | ||||||||||
| Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | |
| 37Rb | 38 Sr | 5s | ||||||||
| | ¯ | |||||||||
| 31Ga | 32Ge | 33 As | 34 Se | 35 Br | 36 Kr | 4p | ||||
| | | | ¯ | ¯¯ | ¯¯¯ | |||||
| 3d | ||||||||||
| Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | |
| 19 K | 20Ca | 4s | ||||||||
| | ¯ | |||||||||
| 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | 3p | ||||
| | | | ¯ | ¯¯ | ¯¯¯ | |||||
| 11Na | 12Mg | 3s | ||||||||
| | ¯ | |||||||||
| 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | 2p | ||||
| | | | ¯ | ¯¯ | ¯¯¯ | |||||
| 3 Li | 4 Be | 2s | ||||||||
| | ¯ | |||||||||
| 1 H | 2 He | 1s | ||||||||
| | ¯ |
Рис. 1.19. Энергетическая схема заполнения электронных орбиталей
