Основные понятия и законы химии
1.1. Определение химии. Предмет химии. Её связь с другими науками. Значение химии в изучении природы и развитии техники.
Качество подготовки инженеров существенно зависит от уровня их образования в области фундаментальных наук: математики, физики и химии. Роль и место химии в системе естественнонаучных дисциплин определяется тем, что в области материального производства человеку всегда приходится иметь дело с веществом.
В повседневной жизни мы наблюдаем, что вещества подвергаются различным изменениям: стальной предмет во влажном воздухе покрывается ржавчиной; дрова в печи сгорают, оставляя лишь небольшую кучку золы; бензин в двигателе автомобиля сгорает, при этом в окружающую среду поступает около двухсот различных веществ, в том числе токсичных и канцерогенных; опавшие листья деревьев постепенно истлевают, превращаясь в перегной, и т.д.
Познание свойств вещества, строения, химической природы его частиц, механизмов их взаимодействия, возможных путей превращения одного вещества в другое, - эти проблемы составляют предмет химии.
Химия – это наука о веществах и законах их превращений.
Как одна из отраслей естествознания, химия связана с другими естественными науками. Химические изменения всегда сопровождаются изменениями физическими. Широкое применение физических методов исследования и математического аппарата в химии сблизило её с физикой и математикой. Химия также связана и с биологией, поскольку биологические процессы сопровождаются непрерывными химическими превращениями. Химические методы используют для решения проблем геологии. Связь между различными естественными науками очень тесная, на стыках наук возникают новые науки, например, ядерная химия, биохимия, геохимия, космохимия и т.д.
Изучение химическими методами ряда технических проблем связывает химию с инженерно – техническими и специальными дисциплинами, необходимыми для практической деятельности инженера. Так, производство стали и других сплавов, чистых металлов и полупроводников, выработка из них изделий и их дальнейшее использование, эксплуатация различных механизмов в соответствующих газовых и жидких средах – всё это требует конкретных химических знаний и умения применить их на практике.
Нет почти ни одной отрасли производства, не связанной с применением химии. Природа даёт нам исходное сырьё: дерево, руду, нефть, газ и др. Подвергая природные материалы химической переработке, человек получает разнообразные вещества, необходимые для сельского хозяйства, промышленности, домашнего обихода: удобрения, металлы, пластические массы, краски, лекарственные вещества, мыло, соду и т.д. Химия нужна человечеству для того, чтобы получить из природных веществ, всё необходимое – металлы, цемент и бетон, керамику, фарфор и стекло, каучук, пластмассы, искусственные волокна, фармацевтические средства. Для химической переработки природного сырья необходимо знать общие законы превращения веществ, а эти знания даёт химия.
В современных условиях, когда стало ясно, что запасы многих природных ресурсов ограничены и не восстанавливаются, когда нагрузка на окружающую среду со стороны человека стала столь велика, а способность природы к самоочищению ограничена, на первый план выдвигается ряд принципиально новых проблем, решение которых невозможно без химических знаний. К ним в первую очередь относятся вопросы охраны окружающей среды и соблюдение экологических требований в новых технологических процессах, создание замкнутых производственных циклов и безотходных технологий, теоретическое обоснование и разработка энерго- и ресурсосберегающих технологий. Реализация требований к высокому качеству продукции и её долговечности немыслима без понимания того, что контроль за химическим составом является важнейшим этапом технологического цикла. Борьба с коррозией материалов, изделий из них, новые методы обработки поверхностей требуют от инженера глубокого понимания сущности химических процессов.
Указанные выше проблемы по силам решить всесторонне грамотным инженерам, способным наряду с другими задачами разбираться и самостоятельно ориентироваться в химических вопросах.
Основные понятия химии
Объектом изучения в химии являются химические элементы и их соединения.
Химическим элементом называют вид атомов с одинаковым зарядом ядер. Атом – наименьшая частица элемента, обладающая его химическими свойствами.
Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов.
Если молекулы состоят из одинаковых атомов, то вещество называют простым или элементарным, например He, Ar, H2, O2, S4. Простое вещество является формой существования химического элемента в свободном состоянии. Если молекула вещества состоит из разных атомов, то вещество называют сложным (или химическим соединением), например CO, H2O , H3PO4.
Химические свойства вещества характеризуют его способность участвовать в химических реакциях, т. е. в процессах превращения одних веществ в другие.
Массы атомов, молекул очень малы. Например, массы отдельных атомов составляют 10-24 - 10-22 г. Массы атомов, молекул выражают или в относительных единицах ( через массу какого-либо одного определенного вида атома), или в атомных единицах массы (а.е.м.).
1а.е.м.-это 1/12 часть массы атома изотопа углерода 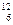 С. 1а.е.м.=1.66053*10-24 г.
С. 1а.е.м.=1.66053*10-24 г.
Значение относительной атомной (Ar) или молекулярной массы (Mr) показывает, во сколько раз масса атома или молекулы больше чем 1/12 часть массы атома изотопа углерода 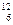 С (углеродная шкала атомных масс). Ar и Мr – безразмерны. Значения Аr приводятся в периодической системе элементов Д.И. Менделеева под символом элемента. Численно Аr и А (а.е.м.) совпадают. Зная относительную атомную массу, легко можно найти и массу атома, выраженную в граммах. Так, масса атома углерода-12 в г равна: 12* 1.66053*10-24= 1.992636*10-23 г. Масса молекулы равна сумме масс атомов, входящих в ее состав.
С (углеродная шкала атомных масс). Ar и Мr – безразмерны. Значения Аr приводятся в периодической системе элементов Д.И. Менделеева под символом элемента. Численно Аr и А (а.е.м.) совпадают. Зная относительную атомную массу, легко можно найти и массу атома, выраженную в граммах. Так, масса атома углерода-12 в г равна: 12* 1.66053*10-24= 1.992636*10-23 г. Масса молекулы равна сумме масс атомов, входящих в ее состав.
Количество вещества (n;n) – это число структурных единиц (атомов, молекул, ионов, эквивалентов, электронов и т.д.) в системе. Единицей измерения количества вещества является моль. Моль – количество вещества, которое содержит столько определенных структурных единиц, сколько атомов содержится в 12 г изотопа углерода 12С. Число структурных единиц, содержащихся в 1 моле любого вещества в любом агрегатном состоянии, есть постоянная Авогадро: NA=6,02*1023 моль-1.
Количество вещества (n) равно отношению числа структурных единиц (атомов, молекул, ионов, эквивалентов, электронов и т.д.) в системе (N) к их числу в 1 моле вещества (NА):

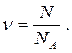
Молярная масса (М) – это масса 1 моль вещества, равная отношению массы вещества (m) к его количеству (n):
М=m/n.
Основной единицей измерения молярной массы является г/моль (кг/моль). Молярная масса вещества, выраженная в граммах, численно равна относительной молекулярной массе этого вещества.
Молярный объем (Vм ) – это объем, занимаемый 1 моль газообразного вещества, равный отношению объема газообразного вещества (V) к его количеству( 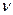 ):
):

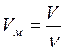 .
.
При н.у. (273,15 К и 101,325 кПа) для любого вещества в газообразном состоянии Vм = 22,4 л/моль.
Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равноценна) одному иону водорода в кислотно-основных или ионно-обменных реакциях или одному электрону в окислительно-восстановительных реакциях (ОВР). Эквивалент безразмерен, его состав выражают с помощью знаков и формул так же, как в случае молекул, атомов или ионов.
Для того чтобы определить формулы эквивалента вещества и правильно записать его химическую формулу, надо исходить из конкретной реакции, в которой участвует данное вещество.
Рассмотрим несколько примеров определения формулы эквивалента:
А. 2NaOH+H2SO4 =2H2O+Na2SO4.
Краткое ионно-молекулярное уравнение процесса:
2OH- +2H+ =2H2O.
В данной ионообменной реакции участвуют два иона водорода. На один ион водорода приходится:
NaOH+1/2H2SO4=H2O+1/2Na2SO4,
т.е. одному иону водорода соответствует: одна молекула NaOH, 1/2 молекулы H2SO4, одна молекула H2O, 1/2 молекулы Na2SO4, поэтому Э(NaOH)=NaOH; Э(H2SO4)=1/2H2SO4; Э(H2O)=H2O; Э(Na2SO4)=1/2Na2SO4.
Б. Zn+2HCl=ZnCl2+H2
Ионно-электронные уравнения процессов окисления, восстановления:
Zn-2e=Zn2+,
2H++2e=H2.
В данной ОВР участвуют два электрона. На один электрон приходится:
1/2Zn+HCl=1/2ZnCl2+1/2H2,
т.е. одному электрону соответствует 1/2 атома Zn, одна молекула HСl,1/2 молекулы ZnCl2 и 1/2 молекулы Н2, поэтому Э(Zn) = 1/2Zn; Э(HCl) = HCl; Э(ZnCl2) = 1/2ZnCl2; Э(H2) = 1/2H2.
Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, получило название фактора эквивалентности fэ. Например, в рассматриваемых реакциях fэ(Zn)=1/2, fэ(NaOH)=1.
Для окислительно-восстановительных реакций используют понятие «эквивалентное число» (Z), которое равно числу электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
Моль эквивалента – количество вещества, cодержащего 6,02*1023 эквивалентов. Массу одного моля эквивалента вещества называют молярной массой эквивалента вещества (Мэ), измеряют в г/моль и рассчитывают по формулам:
Мэ=m/nэ; Мэ=fэ*М,
где М – молярная масса вещества, г/моль; νэ – количество эквивалента вещества, моль.
Для расчета молярной массы эквивалента вещества можно использовать следующие формулы:
1. Для простого вещества:
Мэ=МА/В, fэ = 1/В,
где МА – молярная масса атомов данного вещества; В – валентность атома, например, Мэ(Al)=27/3=9 г/моль.
2. Для сложного вещества:
Мэ=М/В*n, fэ = 1/В*n,
где В – валентность функциональной группы; n – число функциональных групп в формуле молекулы вещества.
Для кислот функциональной группой является ион водорода, для оснований – ион гидроксила, для солей – ион металла, для оксидов – оксидообразующий элемент.
Мэ кислоты=Мкислоты/основность кислоты.
Основность кислоты определяется числом протонов, которое отдает молекула кислоты, реагируя с основанием.
Например, Мэ(H2SO4)=98/2=49 г/моль.
Мэ основания = Моснования/кислотность основания.
Кислотность основания определяется числом протонов, присоединяемых молекулой основания при взаимодействии его с кислотой.
Например, Мэ(NaOH)=40/1=40 г/моль.
Мэ соли=Мсоли/(число атомов металла*валентность металла).
Например, Мэ(Al2(SO4)3)=342/(2*3)=57 г/моль.
Мэ оксида=Моксида/(число атомов оксидообразующего элемента * валентность элемента).
Например, Мэ(Al2O3)=102/(2*3)=17 г/моль.
В общем случае молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
3. Для окислителя, восстановителя:
Мэ=М/Z,
где Z – эквивалентное число (Z=1/f э).
Как известно, моль любого газа при нормальных условиях (Т=273,15 К, Р=101,325 кПа или 760 мм рт. ст.) занимает объем, равный 22,4 л; этот объем называется молярным объемом Vм. Исходя из этой величины, можно рассчитать объем одного моля эквивалента газа (Vэ, л/моль) при нормальных условиях. Например, для водорода Э(Н2)=1/2Н2, моль эквивалента водорода в два раза меньше его моля молекул и поэтому объем одного моля эквивалента водорода также в два раза меньше его молярного объема: 22,4 л/2=11,2 л. Для кислорода Э(О2)=1/4 О2, отсюда объем одного моля эквивалента кислорода в четыре раза меньше его молярного объема: 22,4 л/4=5,6 л.
В общем случае: Vэ=fэ*Vм; Vэ= V/ 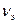 .
.
Основные законы химии
1. Закон сохранения массы веществ ( М.В. Ломоносов; 1756 г.):
масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
2. Закон постоянства состава.
Имеет различные формулировки:
- состав соединений молекулярной структуры является постоянным независимо от способа получения (более точная современная формулировка);
- любое сложное вещество независимо от способа его получения имеет постоянный качественный и количественный состав;
- соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способа получения этого соединения.
3. Закон кратных отношений (Дальтон , 1803 г.):
если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон свидетельствовал о том, что элементы входят в состав соединений лишь определенными порциями, подтвердил атомистические представления. Наименьшее количество элемента, вступающее в соединение, - это атом. Следовательно, в соединение может вступать только целое число атомов, а не дробное. Например, массовые соотношения С:О в оксидах СО2 и СО равны 12:32 и 12:16. Следовательно, массовое отношение кислорода, связанное с постоянной массой углерода в СО2 и СО, равно 2:1.
4. Закон объемных отношений (закон Гей-Люссака):
объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.
5.Закон Авогадро(1811 г.):
в равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул. Постоянная Авогадро NA = 6,02*1023 моль-1 – число структурных единиц в одном моле вещества.
Следствия из закона Авогадро:
а) при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем;
б) при н.у. (273,15 К и 101,325 кПа) молярный объем (Vм) любого газа равен 22,4 л моль.[1]
6.Уравнениесостояния идеального газа – Менделеева-Клапейрона:
PV=mRT/M,
где Р – давление газа, Па; V – объем газа, м3; m – масса вещества, г; М – его молярная масса, г/моль; Т – абсолютная температура, К; R – универсальная газовая постоянная, равная 8,314 Дж/моль*К.
7. Закон парциальных давлений (закон Дальтона):
Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь.[2]
8. Закон эквивалентов.
Имеет несколько формулировок:
1) массы участвующих в реакции веществ пропорциональны их молярным массам эквивалента:
m1 / m2 = M Э1/ M Э2 = …;
2) все вещества реагируют между собой в эквивалентных количествах, т.е. количества молей эквивалента веществ, участвующих в реакции, равны между собой:
νэ1=νэ2= …;
m1 / M Э1= m2 / M Э2=… ..
3) для реагирующих веществ, находящихся в растворе, закон эквивалентов записывают следующим образом:
СЭ1*V1=CЭ2*V2,
где СЭ1, СЭ2 – нормальные концентрации или молярные концентрации эквивалента первого и второго растворов, моль/л; V1 и V2 – объемы реагирующих растворов, л.
