Модуль 1. основные законы и понятия химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ЛАБОРАТОРНЫМ ЗАНЯТИЯМ
МОДУЛЬ 1. ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
Основные классы неорганических соединений: оксиды, основания, кислоты.
Вопросы для подготовки к занятию
1. Оксиды. Классификация, способы получения и химические свойства.
2. Гидроксиды: классификация.
3. Основные гидроксиды (основания): классификация, способы получения и свойства. Диссоциация.
4. Кислотные гидроксиды (кислородсодержащие кислоты) и бескислородны кислоты. Классификация кислот, номенклатура, способы получения и свойства. Диссоциация.
5. Амфотерные гидроксиды.
Индивидуальные химические вещества могут быть простыми и сложными. Все простые вещества условно делят на металлы и неметаллы. К неметаллам относят: H, He, B, C, N, O, F, Ne, Si, P, Sb, Cl, Ar, As, Se, Br, Kr,Te, I, Xe, Rn. Остальные элементы проявляют металлические свойства.
Сложные неорганические вещества делят на классы, основными из которых являются оксиды, гидроксиды (основания, кислоты, амфотерные гидроксиды), соли. Деление сложных веществ на классы основано на сходстве химических свойств.
Оксиды
Оксидами называют сложные вещества, состоящие из двух элементов, одним из которых является кислород со степенью окисления –2. Различают солеобразующие и несолеобразующие оксиды. Из несолеобразующих оксидов (их немного) невозможно получить соли. К ним относятся, например, NO –оксид азота (11), NO2 –оксид азота (1V), СО –оксид углерода (11). Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды –этооксиды металлов со степенью окисления +1, +2. Например, Na2O –оксид натрия, СаО –оксид кальция, FeO – оксид железа (11), MnO – оксид марганца (11). Основным оксидам соответствуют основания: NaOH, Са(ОН)2, Fe(OH)2, Mn(OH)2.
Амфотерные оксиды –это cоединения, которые проявляют свойства основных и кислотных оксидов. Они образованы металлами в степени окисления + 2, + 3, + 4. К ним относятся: BeO, ZnO, SnO, PbO, Al2O3, Cr2O3, Fe2O3, SnO2, PbO2, MnO2, TiO2 и др. Им соответствуют амфотерные гидроксиды: Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3, Fe(OH)3, Sn(OH)2, Pb(OH)4 ,Mn(OH)4 , Ti(OH)4.
Кислотные оксиды: это оксиды неметаллов и металлов в высшей степени окисления. Например, СО2 –оксид углерода (1V), N2O5 –оксид азота (V), Mn2O7 –оксид марганца (VII), CrO3 –оксид хрома (VI). Этим оксидам соответсвуют кислоты: H2CO3, HNO3, HMnO4, H2CrO4, H2Cr2O7.
Химические свойства основных оксидов
· Оксиды щелочных и щелочноземельных металлов растворяются в воде:
K2O + H2O = 2KOH ; CaO + H2O = Ca(OH)2
оксид гидроксид ; оксид гидроксид
калия калия ; кальция кальция
· основные оксиды взаимодействуют с кислотными оксидаси и кислотами с образованием солей:
CaO + SiO2 = CaSiO3 ; BaO + H2SO4 = BaSO4 + H2O
соль –силикат кальция ; соль –сульфат бария
· Основные оксиды взаимодействуют с амфотерными оксидами и гидроксидами:
K2O + ZnO = K2ZnO2 ; K2O + Zn(OH)2 = K2ZnO2 + H2O
соль –цинкат калия; соль –цинкат калия
Химические свойства кислотных оксидов
· Кислотные оксиды растворяются в воде (кроме песка SiO2) с образованием кислот:
SO2 + H2O = H2SO3 ; Mn2O7 + H2O = 2HMnO4
сернистая кислота; марганцовая кислота
Формулу кислоты, соответствующей кислотному оксиду, можно найти, записав реакцию взаимодействия оксида с водой. Если индексы у атомов элементов, входящих в состав молекулы кислоты оказываются кратными какому - либо числу, то при записи простейшей формулы индексы сокращают на это число, а его записывают перед формулой кислоты:
N2O5 + H2O = H2N2O6 = 2HNO3 ; Br2O5 + H2O = H2Br2O6 =HBrO3
азотная кислота ; бромноватая кислота
· Кислотные оксиды взаимодействуют с основными оксидами и основаниями:
CO2 + Na2O = 2 Na2CO3 ; CO2 + 2NaOH = Na2CO3 + H2O
Na2CO3 - соль –карбонат натрия;
P2O5 + 6KOH = 2K3PO4 + H2O
соль – ортофосфат калия
· Кислотные оксиды реагируют с амфотерными оксидами и гидроксидами:
SO3 + ZnO = ZnSO4 ; SO3 + Zn(OH)2 = ZnSO4 + H2O
ZnSO4 - соль – сульфат цинка
Химические свойства амфотерных оксидов
· Амфотерные оксиды взаимодействуют с кислотными оксидами и кислотами, проявляя свойства основных оксидов:
Cr2O3 + 3SO3 = Cr2(SO4)2; ZnO + 2HCl = ZnCl2 + H2O
· Амфотерные оксиды взаимодействуют с основными оксидами и основаниями, проявляя свойства кислотных оксидов:
BeO + K2O = K2BeO2 ; BeO + 2KOH = K2BeO2 + H2O
Гидроксиды
Гидроксиды обычно рассматривают как продукты взаимодействия оксидов с водой независимо от того, наблюдается это взаимодействие в действительности или гидроксид может быть получен только косвенным путем (например, реакцией обмена соли со щелочью). Основным оксидам соответствуют основания, кислотным –кислоты, амфотерным оксидам –амфотерные гидроксиды.
Химические свойства кислот
Кислотами называют соединения, в состав которых входят ионы водорода, способные замещаться на катионы металла, и анионы кислот (SO42–, CO32–, Cl–, PO43–, NO3– и т.д.).
Различают бескислородные и кислородсодержащие кислоты. Бескислородными кислотами являются водные растворы некоторых водородных соединений элементов (неметаллов VI, VII групп периодической системы элементов: HCl, HBr, HI, H2S, H2Se, H2Te), а также HSCN, HCN.
Кислородсодержащие кислоты получают растворением кислотных оксидов в воде, поэтому их относят классу гидроксидов:
SO2 + H2O = H2SO3; N2O3 + H2O = 2HNO2; P2O5 + 3 H2O = 2H3PO4. Кислородсодержащие кислоты имеют общую формулу HхЭОу.
· Кислоты взаимодействуют с основными оксидами и гидроксидами. При этом образуются соль и вода:
H2SO4 + СuO = CuSO4 + H2O; H2SO4 + Сu(OH)2 = CuSO4 + 2H2O;
· Кислоты реагируют с амфотерными оксидами и гидроксидами:
2HNO3 + ZnO = Zn(NO3)2 + H2O; 2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
· Кислоты взаимодействуют с солями, если в результате образуется нерастворимое соединение:
BaCl2 + H2SO4 = BaSO4↓ + H2O
· При нагревании некоторые кислородсодержащие кислоты разлагаются на воду и кислотный оксид:
H2SiO3 = SiO2 + H2O
Упражнения
1. Среди перечисленных оксидов укажите основные и кислотные: а) оксид кальция; б) оксид серы (VI), в) оксид фосфора (V), г) оксид меди (II), д) оксид железа (II), е) оксид хрома (VI). Напишите формулы гидроксидов, соответствующих этим оксидам.
2. Напишите уравнения реакций между оксидом бария со следующими веществами: а) водой, б) оксидом углерода (IV), в) азотной кислотой, г) соляной кислотой.
3. Напишите уравнения реакций между оксидом серы (VI) и следующими веществами: а) оксидом лития, б) водой, в) оксидом алюминия, г) гидрокисдом натрия.
4. С какими из перечисленных веществ может реагировать гидроксид меди (II): а) азотная кислота, б) кремниевая кислота, в) хлорид натрия, г) серная кислота. Напишите уравнения реакций в молекулярной и ионной формах.
5. Составьте уравнения реакций в молекулярной и ионной формах между гидроксидом калия и следующими веществами: а) хлоридом железа (III), б) сульфатом меди (II), в) оксидом углерода (IV), г) оксидом фосфора (V), д) оксидом серы (VI).
6. Составьте уравнения реакций, соответствующих следующей цепочке превращений:
Ва → ВаО → Ва(ОН)2 → ВаСО3 → Ва(NО3)2
7. Напишите уравнения реакций между серной кислотой и следующими веществами: а) цинком, б) оксидом кальция, в) карбонатом магния, г) оксидом железа (III).
8. В трех пробирках имеются растворы веществ: соляной кислоты, серной кислоты, гидроксида натрия. Предложите способ, при помощи которого можно различить эти растворы.
ЛАБОРАТОРНАЯ РАБОТА
Свойства кислот и оснований
Приборы и реактивы: 2 н. раствор соляной и серной кислот, 0,2 н. раствор гидроксида натрия или калия, 2 н. раствор хлорида железа (II), 2 н. раствор хлорида алюминия, 2 н. раствор сульфата цинка, 2 н. раствор сульфата меди; штатив с пробирками, фарфоровая чашка, спиртовка.
Опыт 1. Открытие катиона водорода в растворе.
В три пробирки налить по 1 мл раствора соляной кислоты. В одну из них добавить 3 – 4 капли лакмуса, в другую – 3 – 4 капли метилоранжа, в третью – столько же фенолфталеина. Отметить изменение окраски индикаторов. (Результаты внести в таблицу).
Опыт 2. Открытие гидроксид-иона в растворе.
В три пробирки налить по 1 мл раствора гидроксида натрия. Затем в каждую из них добавить по 3 – 4 капли растворов лакмуса, метилоранжа, фенолфталеина. Наблюдать изменение окраски индикаторов. (Результаты внести в таблицу.)
| Индикатор | HCl | NaOH |
| Лакмус | ||
| Метилоранж | ||
| Фенолфталеин |
Опыт 3. Солеобразование.
В фарфоровую чашку налить 1 мл раствора соляной кислоты и столько же по объему раствора гидроксида натрия. Смесь нагреть до полного испарения воды. Остается поваренная соль, убедиться можно по вкусу. Написать уравнение реакции в молекулярной и ионной формах.
Опыт 4. Амфотерность гидроксидов.
В 4 пробирки к 1 мл растворов солей железа (II), цинка, алюминия, меди добавить по каплям раствор гидроксида натрия. Полученные осадки гидроксидов разделить на две части и проверить их растворимость в минеральных кислотах и щелочах. Отметить какие гидроксиды растворяются только в кислотах, какие – в кислотах и щелочах. Составить уравнения реакций в молекулярной и ионной формах.
1.2. Получение и изучение химических свойств солей.
Вопросы для подготовки к занятию
1. Классификация солей: средние, кислые, основные, двойные, смешанные. Номенклатура.
2. Способы получения средних солей.
3. Способы получения основных и кислых солей.
4. Химические свойства.
Cоли
При взаимодействии соединений основного характера с соединениями кислотного характера образуются соли. По составу различают следующие типы солей: средние, кислые и основные соли.
Средняя соль – это продукт полного замещения ионов водорода в молекуле кислоты ионами металла или гидроксогрупп в молекуле основания кислотными остатками. Например, Na2S, CuSO4.
Упражнения
1. Напишите ступенчатую диссоциацию солей: а) гидроксохлорида алюминия, б) дигирофосфата калия, в) гидроксонитрата висмута, г) гидроксохлорида магния, в) гидросульфида бария.
2. С каким из перечисленных веществ будет реагировать сульфат меди (II): а) серой, б) оловом, в) серебром, г) гидроксидом бария, д) оксидом железа (III), е) хлоридом бария?
3. Напишите уравнения реакций, с помощью которых можно получить хлорид магния исходя из следующих веществ: а) магния, б) оксида магния, в) гидроксида магния, г) карбоната магния, д) сульфата магния.
4. Допишите схемы реакций получения солей и составьте уравнения:
MgO + H3PO4 →
Cr2O3 + HNO3 →
CO2 + NaOH →
H2SO4 + … →KHSO4 + …
Fe2(SO4)3 + KOH →
Cu(NO3)2 + Mg →
Fe2(SO4)3 + Ba(NO3)2 →
ЛАБОРАТОРНАЯ РАБОТА
Стехиометрические законы
Вопросы для подготовки к занятию
1. Понятие химический элемент. Простое и сложное вещество. Определение относительных атомных и молекулярных масс. Основные положения атомно-молекулярного учения.
2. Количество вещества, моль. Молярная масса.
3. Закон сохранения массы веществ. Расчеты по уравнениям химических реакций.
4. Закон Авогадро. Молярный объем. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
5. Химический эквивалент. Молярная масса эквивалента. Фактор эквивалентности. Закон эквивалентов.
Простые вещества состоят из атомов одного химического элемента. Они делятся на металлы и неметаллы. Металлы- натрий Na, серебро Ag, алюминий Al, и т.д. Это вещества с металлическим блеском, ковкие, пластичные, тепло и электропроводные. Неметаллы – сера S8, кислород О2 , йод I2 и т.д. у них отсутствуют металлический блеск, они хрупкие, плохо проводят электрический ток и теплоту.
Сложные вещества состоят из атомов нескольких химических элементов. Р2О5 оксид фосфора (V), H2SO4 серная кислота, NaCl соль – хлорид натрия и т.д.
Химический элемент – это вид атомов с одинаковым зарядом атомного ядра. Вид атомов с зарядом ядер +1 – это химический элемент водород. В настоящее время открыто и искусственно получено 110 химических элементов. Они делятся на металлы (Na, Ca, Mg и т.д.), неметаллы (F, O, S, и т.д.) и переходные элементы (Zn, Al, Pb и т.д.). каждый химический элемент имеет условное обозначение: химический знак, он состоит из одной или двух букв латинского алфавита. Эти буквы являются первой и последующей буквой латинского названия элемента.
Н (аш) – водород, Hydrogenium.
Аg (аргентум) – серебро, Argentum.
Каждый химический элемент имеет своё название. Названия у химических элементов не случайные.
Атомные и молекулярные массы. Их выражают в атомных единицах массы (а.е.м.). В настоящее время за атомную единицу массы принимается 1/12 часть массы атома углерода – 12 (изотоп 612С), что составляет 1,66*10-27 кг. Чтобы рассчитать относительную массу атома, надо найти отношение массы атома к 1/12 части массы атома углерода-12. Например, масса атома изотопа фтора 19F равна 3,1553*10-26 кг. Тогда относительная атомная масса этого атома Ar (19F) составит: Ar(19F)= 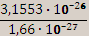 =18,998.
=18,998.
Относительную молекулярную массу Мr можно рассчитать, сложив относительные атомные массы Ar элементов, из которых состоит молекула, с учетом числа атомов, входящих в молекулу. Mr (H2SO4) = 1*2+32+16*4=98. Для веществ с кристаллической (немолекулярной) структурой относительную молекулярную массу рассчитывают для условной молекулы, состав которой соответствует простейшей формуле.
Моль. Одной из основных физических величин является количество вещества. В соответствии с международной системой единиц (СИ) единицей количества вещества, измерения, служит моль. Моль-количество вещества, которое содержит столько структурных единиц (т.е. атомов, молекул, ионов, электронов), сколько содержится атомов в 12 г изотопа углерода – 12.
Постоянная Авогадро. – это постоянная величина NA=6,02*1023 моль-1. Число атомов в 12г 12С равно 6,02*1023. Постоянная Авогадро показывает число структурных единиц в одном моле любого вещества.
Молярная масса- это отношение массы вещества к его количеству.
М (в-ва) = 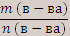 . Единица СИ молярной массы- кг/моль или г/моль.
. Единица СИ молярной массы- кг/моль или г/моль.
Молярная масса вещества (в г/моль) численно равна относительной атомной или молекулярной массе этого вещества. Mr (H2SO4) = 98.
М (H2SO4) = 98 г/моль.
- Закон сохранения массы веществ
Этот закон открыт в 1756 г. русским ученым М.В. Ломоносовым.
« Масса веществ вступивших в химическую реакцию равна массе веществ получившихся в результате химической реакции».
М.В. Ломоносов прокаливал металлы в реторте (запаянный сосуд) и обнаружил, что вес веществ до и после реакции остался неизменным. Открытие этого закона способствовало развитию химии, как науки; утверждению атомно-молекулярного учения; на основании этого закона составляются уравнения химических реакций и по ним проводятся важные расчеты.
- Закон постоянства состава веществ. Открыт в 1779 г. Французским химиком Ж. Л. Прустом. «Состав любого химически чистого вещества постоянен независимо от способа получения и места нахождения».
Согласно этому закону вещества вступают в химические реакции в определенных массовых отношениях.
Fe + S  FeS
FeS
56г 32г  88 г./ сократим на 8.
88 г./ сократим на 8.
7г : 4г 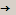 11г.
11г.
Берем 8г + 4г 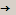 11г FeS и 1г Fe в остатке.
11г FeS и 1г Fe в остатке.
Берем 7г + 5г 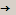 11г FeS и 1г S в остатке.
11г FeS и 1г S в остатке.
Этот закон дал химикам возможность выражать состав веществ при помощи химических формул: Н2О вода, СО2 углекислый газ и т.д. состав веществ определяется экспериментально.
- Закон Авогадро. Открыт итальянским ученым Авогадро.
«в равных объёмах любых газов при одинаковых внешних условиях (температуре и давлении) содержится одинаковое число молекул.»
Следствие из закона Авогадра:
« 1 моль любого газа при постоянных условиях всегда занимает один и тот же объем».
«1 моль любого газа при нормальных условиях (00 С или 2730 К и Р = 101,325 кПа) занимает объем 22,4 л.»
Постоянная 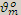 =22,4 л/моль называется молярным объёмом газа при н.у.
=22,4 л/моль называется молярным объёмом газа при н.у.
Из закона Авогадро следует, что если объемы двух газов при постоянных условиях равны, то и равно число молекул двух газов.
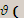 1 газа) =
1 газа) = 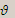 (2 газа) при постоянных условиях.
(2 газа) при постоянных условиях. 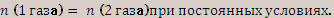 отсюда,
отсюда,
D газа1 / газу2= 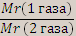
D – относительная плотность одного газа по второму. При расчетах чаще всего пользуются относительными плотностями газов по водороду Dн2 и по воздуху Dвоздуха, их определяют экспериментально и по ним вычисляют относительную молекулярную массу газа.
- Закон эквивалентов.
« Массы элементов и веществ, участвующих в химических реакциях, относятся друг к другу, как их эквиваленты».
Математическое выражение закона эквивалентов: m1 : m2= э1 : э2 или m1: э1= m2 : э2.
Отсюда: 1) элементы и вещества участвуют в химических реакциях в одинаковых количествах их эквивалентов; 2) масса элемента или вещества в граммах, численно равная эквиваленту, называется грамм-эквивалентом.
Величина эквивалента зависит от типа и характера химической реакции, в которой участвует данный элемент или вещество.
Эквивалентом вещества называется некоторая условная частица этого вещества, которая в данной реакции соединяется с одним атомом или ионом водорода либо замещает его.
Ca(OH)2 + 2 HCl 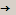 CaCl2 + 2 H2O
CaCl2 + 2 H2O
В этой реакции одному иону водорода эквивалентна условная частица, равная ½ Са(ОН)2. Это и будет эквивалентом гидроксида кальция. Число1/2 носит название фактора эквивалентности: f эквивалента. [ Са(ОН)2]=1/2
Молярная масса эквивалента вещества вычисляют по формуле:
М эквивалента. [ Са(ОН)2]= f экв. * М =1/2 * 74 г/моль=37г/моль.
Количество вещества эквивалента – это отношение массы вещества к молярной массе эквивалента вещества.
N экв. (в-ва) = 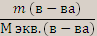 , если m [ Са(ОН)2]=100 г ,
, если m [ Са(ОН)2]=100 г ,
то n экв. [ Са(ОН)2]= 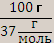 =2,7 моль.
=2,7 моль.
Упражнения
1. 250 мл неизвестного газа, взятого при нормальных условиях, имеют массу 0,357 г. Определить молярную массу газа.
2. Определить молярную массу газа, если его плотность по воздуху равна 0,965.
3. Определить плотность хлора по водороду и кислороду, если масса 1 л его при н.у. 3,16 г, масса 1 л водорода 0.089 г и 1 л кислорода - 1,43 г.
4. 100 г газа при 47° С и давлении 405.2 кПа занимает объем 41 л. Найти молекулярную массу газа.
5. Найти эквивалент металла, если его оксид содержит 79,9% металла и 20,1% кислорода.
6. При соединении 4,5 г трехвалентного металла с серой образовалось 12,5 г сульфида этого металла. Определить эквивалентную массу и название металла.
7. Найти эквивалентные массы следующих веществ: HCl, H2SO4, KOH, Cu(OH)2, FeCl3, Al2(SO4)3, Na2O, P2O5.
8. Неизвестный газ имеет относительную плотность по воздуху 1,31. Определите массу образца этого газа объемом 168 л.
9. Замкнутый сосуд с оксидом серы (IV) содержит при нормальных условиях 2,1·1022 молекул. Определите вместимость сосуда и массу находящегося в нем газа.
10. Вычислите относительную плотность по водороду газовой смеси, состоящей из оксида углерода (II) объемом 56 л и оксида углерода (IV) объемом 28 л.
Химическая термодинамика
Вопросы для подготовки к занятию
1. Превращения энергии при химических реакциях. Экзо- и эндотермические реакции.
2. Стандартатные термодинамические величины. Термохимические расчеты.
3. Термодинамические величины. Внутренняя энергия и энтальпия.
4. Энтропия и энергия Гиббса
5. Определение теплоты реакции нейтрализации
Термодинамический подход заключается в рассмотрении начального и конечного состояний взаимодействующих веществ, при этом не учитываются механизм и скорость процесса.
Для описания систем используют набор термодинамических функций, основными из которых являются Н – энтальпия, S – энтропия, G – энергия Гиббса. В справочных таблицах приводят стандартные: энтальпии образования веществ 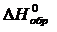 , кДж/моль, энтропии веществ
, кДж/моль, энтропии веществ 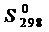 , Дж/(моль×К) (табл. П.1), энергии Гиббса образования веществ
, Дж/(моль×К) (табл. П.1), энергии Гиббса образования веществ 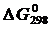 , кДж/моль. Стандартные условия:
, кДж/моль. Стандартные условия:
Т = 298 К; Р = 1,013×105 Па; вещества –химически чистые.
Энтальпийный эффект химической реакции определяют по закону Гесса и
следствию из него. Следствие из закона Гесса: изменение энтальпии химической реакции равно разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрическихкоэффициентов:
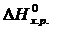 = å(n
= å(n 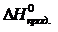 ) – å (m
) – å (m 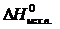 ),
),
где n, m – стехиометрические коэффициенты.
Аналогичным образом можно рассчитывать изменение и других функций – энтропии ( 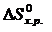 ), энергии Гиббса (
), энергии Гиббса ( 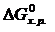 ).
).
В системах, находящихся при постоянных температуре и давлении, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением энергии Гиббса (DG < 0). Если DG > 0 , реакция протекает в обратном направлении, а при DG = 0 система находится в состоянии химического равновесия.
Пример. Вычислить стандартные изменения энтальпии, энтропии, энергии Гиббса в реакции CO2(г) + С (графит) = 2CO(г). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении.
Решение.
· Рассчитать стандартное изменение энтальпии реакции:
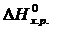 = å (n
= å (n 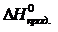 ) – å (m
) – å (m 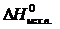 )= 2
)= 2 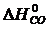 – (
– ( 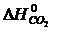 +
+ 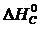 )=
)=
= 2×(–110,5) – (–393,5 + 0) = 172,5 кДж.
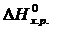 >0 – эндотермическая реакция.
>0 – эндотермическая реакция.
· Рассчитать стандартное изменение энтропии реакции:
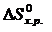 = å (n
= å (n 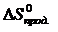 ) – å (m
) – å (m 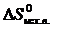 )=
)= 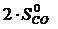 – (
– ( 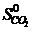 +
+ 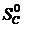 ) =
) =
=2·197,5 – (213,7 + 5,7) = 175,6 Дж/К = 175,6×10-3 кДж/К.
· Рассчитать стандартное изменение энергии Гиббса реакции:
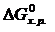 =
= 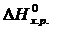 –
– 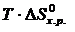 = 172,5 –298×175,6×10-3 = 120,2 кДж.
= 172,5 –298×175,6×10-3 = 120,2 кДж.
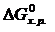 > 0, при Т = 298 К прямая реакция невозможна.
> 0, при Т = 298 К прямая реакция невозможна.
· Определить температуру, при которой устанавливается химическое равновесие.
Если пренебречь зависимостями 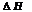 и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS »
и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS » 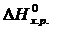 –
– 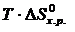
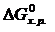 =
= 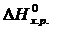 –
– 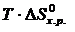 = 0 Þ Т =
= 0 Þ Т = 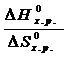 =
= 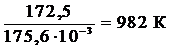
· Построить график зависимости 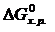 от Т.
от Т.
 |
Из графика видно, что в интервале температур 0 – 982 К DG > 0, следовательно, прямая реакция невозможна; выше 982 К DG < 0, т.е. самопроизвольно протекает прямая реакция.
Упражнения
1. Рассчитать тепловой эффект (энтальпию) реакции
С12Н22О11(к) + 12О2(г) = 12СО2(г) + 11Н2О(ж); ΔН - ?
при стандартных условиях.
2. Водяной газ состоит из равных объемов Н2 и СО. Найти количество тепла, выделяющегося при сжигании 112 л водяного газа при нормальных условиях.
3. Возможна ли при стандартных условиях реакция:
СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж)
4. Возможна ли при стандартных условиях реакция TiO2(к) + 2C(гр) = Ti(к) + 2CO(г) ? Возможна ли эта реакция при температуре 50ºС и 100ºС? При какой температуре наступает химическое равновесие?
5. Какое количество теплоты выделится при сжигании 1 м3 водорода, измеренного при стандартных условиях, если в результате реакции образуется жидкая вода.
6. Будет ли протекать реакция восстановления ZnO оксидом углерода(II) при стандартных условиях?
Для полного описания химической реакции необходимо знать не только принципиальную возможность ее осуществления (решается термодинамически), но и закономерности протекания во времени, т.е. ее скорость и механизм.
Химические реакции могут проходить в гомогенных и гетерогенных системах. Гомогенной называют систему, однородную по составу и свойствам. Гетерогенной называют систему, состоящую из двух или более однородных частей, отделенных друг от друга поверхностью раздела.
Скорость гомогенной химической реакции определяется изменением кон-центрации одного из исходных веществ или продуктов реакции в единицу времени при неизменном объеме системы.
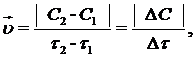
где 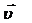 – скорость химической реакции, моль/(л×с); C1 – первоначальная концентрация вещества (в момент времени τ1), моль/л; C2 – концентрация вещества в момент времени τ2 > τ1, моль/л; ΔС – изменение концентрации вещества за время Δτ = τ2 – τ1; τ1,– исходный момент времени, с; τ2 – текущий момент времени, с; (τ2 > τ1).
– скорость химической реакции, моль/(л×с); C1 – первоначальная концентрация вещества (в момент времени τ1), моль/л; C2 – концентрация вещества в момент времени τ2 > τ1, моль/л; ΔС – изменение концентрации вещества за время Δτ = τ2 – τ1; τ1,– исходный момент времени, с; τ2 – текущий момент времени, с; (τ2 > τ1).
В гетерогенных системах реакции идут на поверхности раздела отдель- ных частей системы. Скорость гетерогенной реакции определяют изменением количества вещества, вступившего в реакцию или образующегося в реакции в единицу времени на единице поверхности.
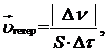
где 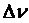 – изменение количества вещества, моль за промежуток времени Δτ, с;
– изменение количества вещества, моль за промежуток времени Δτ, с;
S – площадь поверхности раздела, м2.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации, температуры, присутствия катализаторов.
Влияние концентрации реагирующих веществ
Скорость элементарной химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ с учетом стехиометрических коэффициентов (закон действия масс К. Гульдберга и П.Вааге).
Элементарными называют реакции, протекающие в одну стадию. Математическое выражение зависимости скорости реакции от концентрации реагирующих веществ для других реакций получают экспериментально. Это уравнение называется кинетическим.
Например, для реакцииH2 + I2 = 2 HI 



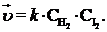
Коэффициент пропорциональности называют константой скорости реакции. Физический смысл k – это скорость реакции при концентрации каждого из реагирующих веществ, равной 1 моль/л.
Влияние температуры
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры (Т) на каждые 10о скорость большинства реакций увеличивается в 2 – 4 раза ( 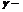 температурный коэффициент):
температурный коэффициент):
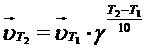
Упражнения
1. Взаимодействие между оксидом углерода и хлором идет по уравнению
CO (г) + Cl2 (г) D COCl2 (г). Исходная концентрация CO равна 0,3 моль/л, Cl2 – 0,2 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию хлора до 0,6, а CO до 1,2 моль/л?
2. На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 81 раз при температурном коэффициенте скорости реакции, равном 3?
3. Константа скорости реакции А + 2В D АВ2 равна 5·10–4 л 2/ (моль2·с).
Рассчитайте скорость прямой реакции при СА = 0,6 моль/л и СВ = 0,8 моль/ л.
4. При температуре 773 К реакция протекает в течение 1 секунды. Сколько времени (секунд) потребуется для ее окончания при 673 К, если температурный коэффициент скорости реакции равен 2?
5. Определить, во сколько раз увеличится скорость прямой реакции
2NO (г) + O2 (г) = 2NO2 (г), если концентрацию каждого из исходных веществ (O2, NO) увеличить в 6 раз?
6. Скорость некоторой реакции при уменьшении температуры с 333 до 303 К уменьшилась в 8 раз. Определить температурный коэффициент скорости этой реакции.
7. Во сколько раз увеличится скорость обратной реакции в гомогенной системе 2N2O5 (г) D O2(г) + 2N2O4(г) при увеличении давления в системе в 3 раза?
8. Во сколько раз уменьшится скорость реакции при понижении температуры на 40º, если температурный коэффициент скорости реакции равен 3?
9. Во сколько раз следует увеличить давление в системе, чтобы скорость обратной реакции возросла в 100 раз? Система: С (к) + H2 O (г) D CO (г) + H2 (г)
10. Две реакции при температуре 283 К протекают с одинаковой скоростью ( 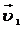 =
= 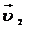 ). Температурный коэффициент скорости первой реакции равен 3, второй равен 4. Как будут относиться скорости реакций (
). Температурный коэффициент скорости первой реакции равен 3, второй равен 4. Как будут относиться скорости реакций ( 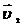 :
: 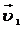 ), если реакцию проводить при 303 К?
), если реакцию проводить при 303 К?
11. Во сколько раз увеличится скорость прямой реакции в гомогенной системе 2N2 (г) + O2 (г) D 2N2O (г) при увеличении давления в два раза?
12.При 273 К реакция заканчивается за один час. Принимая температурный коэффициент скорости реакции равным 3, рассчитайте, сколько минут потребуется на эту же реакцию при 323 К?
13. Взаимодействие между оксидом углерода и хлором происходит по реакции
CO (г) + Cl2 (г) D COCl2 (г). Во сколько раз увеличится скорость прямой реакции при увеличении давления в 4 раза?
14. Скорость некоторой реакции при уменьшении температуры от 333 до 303 К уменьшилась в 27 раз. Определите температурный коэффициент скорости этой реакции.
15. Во сколько раз следует увеличить концентрацию оксида углерода в системе
2CO (г) D CO2 (г) + C(к) , чтобы скорость реакции увеличилась в 16 раз?
16. При увеличении температуры на 40º скорость реакции возросла в 256 раз. Определите температурный коэффициент скорости реакции.
17.Реакция между оксидом азота (II) и хлором протекает по уравнению
2NO (г) + Cl2 (г) D 2NOCl2 (г). Во сколько раз увеличится скорость прямой реакции при увеличении концентрации обоих веществ в два раза?
18.Во сколько раз возрастает скорость некоторой химической реакции при повышении температуры от 298 до 328К, если температурный коэффициент скорости реакции равен 3?
19.Во сколько раз увеличится скорость реакции при повышении температуры на 70º, если температурный коэффициент скорости реакции равен 2?
20. Скорость реакции А + 2В = C при СА = 0,5 моль/л и СВ = 0,6 моль/л равна 1,08 моль/(л·с). Определите константу скорости реакции, л2/(моль2 ·с).
ЛАБОРАТОРНАЯ РАБОТА
Скорость химических реакций
Приборы и реактивы: штативы с пробирками, секундомер, спиртовка, 2 н. раствор H2SO4, 2 н. раствор Na2S2O3, 2 н. раствор NaOH, 2 н. раствор NH4Cl, 0,1 н. раствор KMnO4, кристаллический KNO3, гранулы цинка, порошок MnO2, 3% раствор Н2О2, лучинки.
Опыт 1. Влияние концентрации на скорость химической реакции.
Заполнить 3 пробирки согласно табличным данным:
| Раствор | |||
| Na2S2O3 | 2 мл | 4 мл | 6 мл |
| Н2О | 4 мл | 2 мл | - |
| H2SO4 | 2 мл | 2 мл | 2 мл |
| Время помутнения раствора |
Вначале во все пробирки наливают тиосульфат натрия, затем воду и в последнюю очередь серную кислоту. В момент добавления серной кислоты пускают секундомер и засекают время до появления первых признаков помутнения. Данные заносят в таблицу.
Сравнив время помутнения раствора в каждой пробирке, сделать вывод о влиянии концентрации на скорость реакции.
Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2O
Опыт 2. Влияние температуры на скорость химической реакции.
К 1 мл раствора хлорида аммония прибавить 0,5 мл раствора гидроксида натрия. Запах аммиака чувствуется слегка. Нагреть содержимое пробирки на спиртовке - чувствуется сильный запах аммиака.
Написать уравнение реакции в молекулярной и ионной форме. Сделать вывод о влиянии температуры на скорость химической реакции.
Опыт 3. Гомогенный катализ.
В три пробирки налить по 2 мл раствора серной кислоты и по 2 мл раствора перманганата калия. В первую пробирку насыпать несколько
