Природа химической связи в комплексных соединениях
Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул, способных к самостоятельному существованию в растворе.
Координационную теорию Вернера рассмотрим на примере:
K3[Fe(CN)6]
внешняя и внутренняя сфера
Согласно данной теории, центральный атом или ион, в большинстве случаев в форме катиона (обычно положительно заряженный), координирует (т.е. близко располагает) вокруг себя некоторое число анионов или молекул, которые называются лигандами, (или аддендами – старое название). Простые положительно заряженные катионы в роли лигандов не выступают.
Центральный атом (комплексообразователь)
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L 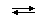 [MLn]
[MLn]
где M – нейтральный атом, положительно или отрицательно заряженный условный ион, объединяющий (координирующий) вокруг себя другие атомы, ионы или молекулы L. Атом M получил название комплексообразователя или центрального атома.
В комплексных ионах [Cu(NH3)4]2+, [SiF6]2- , [Fe(CN)6]4- , [BF4]- комплексообразователями являются медь (II), кремний (IV), железо (II), бор (III). Чаще всего комплексообразователем служит атом элемента в положительной степени окисления.
Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота (III) в катионе аммония [NH4]+ и т.п.
Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], содержат атомы никеля (0) и железа (0).
Комплексообразователь (выделен жирно) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например:
Ag+ + 2NH3 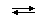 [Ag(NH3)2]+;
[Ag(NH3)2]+;
Ag+ + 2CN- 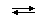 [Ag(CN)2]-
[Ag(CN)2]-
так и находясь в составе молекулы:
SiF4 + 2F- 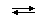 [SiF6]2-
[SiF6]2-
PH3 + H+ 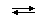 [PH4]+;
[PH4]+;
BF3 + NH3 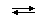 [B(NH3)F3]
[B(NH3)F3]
В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах.
Комплексное соединение может включать несколько комплексных ионов, в каждом из которых содержится свой комплексообразователь.
Например, в одноядерном комплексном соединении состава [K(H2O)6][Al(H2O)6](SO4)2 комплексообразователи K(I) и Al(III), а в [Cu(NH3)4][PtCl6] – Cu(II) и Pt(IV).
Лиганды
В комплексном ионе или нейтральном комплексе вокруг комплексообразователя координируются ионы, атомы или простые молекулы (L). Все эти частицы, имеющие химические связи с комплексообразователем, называются лигандами (от латинского «ligare» - связывать). В комплексных ионах [SnCl6]2- и [Fe(CN)6]4- лигандами являются ионы Cl- и CN-, а в нейтральном комплексе [Cr(NH3)3(NCS)3] лиганды – молекулы NH3 и ионы NCS-.
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
Лигандами могут быть различные неорганические и органические ионы и молекулы. Важнейшими лигандами являются ионы CN-, F- , Cl-, Br-, I-, OH-, SO3S2-, C2O42-, CO32-, молекулы H2O, NH3, CO, карбамида (NH2)2CO, органических соединений – этилендиамина NH2CH2CH2NH2, α-аминоуксусной кислоты NH2CH2COOH и этилендиаминтетрауксусной кислоты (ЭДТА):
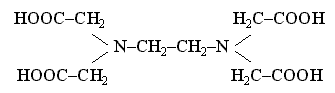
и другие.
Дентатность лиганда
Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH-, тиоцианат-иона NCS-, амид-иона NH2-, монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях (в мостиковых структурах) становятся бидентатными.
Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и т.п. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения:
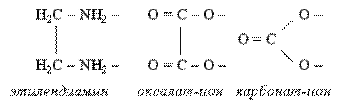 :
:
Например, в комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует две связи с комплексообразователем – условным ионом Co(III), а каждая молекула лиганда NH3 – только одну связь: 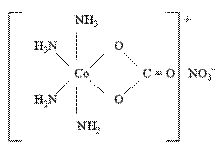
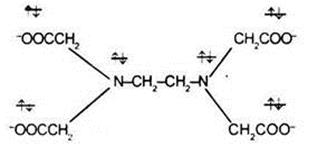
Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты:

Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
Число лигандов, окружающих центральный ион, называется координационным числом (КЧ). Координационное число может иметь значения 2; 3; 4; 5; 6 и т.д. вплоть до 12 (например, для некоторых соединений редкоземельных металлов). Наиболее часто встречаются координационные числа 2; 4; 6. Координационные числа выше 8 встречаются реже.
Значение кч комплексообразователя зависят от многих факторов:
- от природы лиганда и его электронных свойств;
- агрегатного состояния;
- концентрации компонентов;
- температуры раствора;
но обычно оно равно удвоенному заряду иона комплексообразователя.
Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость. Так, для элементов-комплексообразователей, имеющих степень окисления +1 (Ag1, Cu1, Au1, I1 и др.) наиболее характерно координационное число 2 – например, в комплексах типа [Ag(NH3)2]+, [Cu(CN)2]-, [IBr2]-.
Элементы-комплексообразователи со степенью окисления +2 (Zn2, Pt2, Pd2, Cu2 и др.) часто образуют комплексы, в которых проявляют координационное число 4, такие как [Zn(NH3)4]2+, [PtCl4]2-, [Pd(NH3)2Cl2]0, [ZnI4]2-, [Cu(NH3)4]2+.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: [Fe(H2O)6]2+, [Mg(H2O)6]2+, [Ni(H2O)6]2+.
Элементы-комплексообразователи, обладающие степенью окисления +3 и +4 (Pt4, Al3, Co3, Cr3, Fe3), имеют в комплексах, как правило, КЧ=6.
Например, [Co(NH3)6]3+, [Cr(OH)6]3-, [PtCl6]2-, [AlF6]3-, [Fe(CN)6]3-.
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт (III), хром (III) или платина (IV) с КЧ=6 и бор (III), платина (II), палладий (II), золото (III) с КЧ=4. Тем не менее, большинство комплексообразователей имеет переменное координационное число. Например, для алюминия (III) возможны КЧ=4 и КЧ=6 в комплексах [Al(OH)4]- и [Al(H2O)2(OH)4]-.
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9[Bi(NCS)12].
Центральный атом вместе с координированными лигандами образуют внутреннюю координационную (т.е. комплексную) сферу, которую при записи формулы заключают в квадратные скобки. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу. Изображая формулу комплексного соединения, внешнесферные ионы располагают за квадратными скобками.
Например, в соединениях [Cu(NH3)4](OH)2 и K2[HgI4] внешнесферными ионами являются соответственно ионы OH- и K+. В нейтральных комплексах [Cr(NH3)3(NCS)3]0 и [Pd(NH3)2Cl2]0 внешняя сфера отсутствует.
Обычно внешнюю сферу составляют простые одноатомные или многоатомные ионы. Однако возможны случаи, когда комплексное соединение состоит из двух и более внутренних сфер, выполняющих функции катионной и анионной части соединения. Здесь каждая из внутренних сфер является внешней по отношению к другой.
Например, в соединениях [Cu(NH3)4][PtCl6] и [Ni(NH3)6]2[Fe(CN)6] формально функции внешнесферных ионов могут выполнять:
- комплексные катионы [Cu(NH3)4]2+ и [Ni(NH3)6]2+,
- комплексные анионы [PtCl6]2- и [Fe(CN)6]4-.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы. При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава.
Во внутренней сфере связь комплексообразователя с лигандами имеет донорно-акцепторное происхождение и является ковалентной. Роль акцептора электронов выполняет комплексообразователь, имеющий свободные орбитали и достаточно большой положительный заряд ядра, а роль донора выступают лиганды, способные отдавать комплексообразователью неподеленную электронную пару. Ионы, находящиеся во внешней сфере, связаны с комплексным ионам в основном силами электростатическогого взаимодействия.
Определение заряда (z) основных частиц комплексного соединения на примере: K[Al(OH)4].
Заряд внутренней сферы комплексного соединения равен алгебраической сумме зарядов комплексообразователя и всех лигандов:
[Al3+(OH-)4]z -?, z=+3+4×(-1)= -1, т.е [Al(OH)4]-.
Наоборот, зная заряд комплексного иона и заряды лигандов [Al(OH)4]-), можно определить степени окисления комплексообразователя: х+ (-1)×4= -1; х= +3. Степень окисления алюминия +3.
Заряд внутренней сферы компенсируется ионами внешней сферы комплексного соединения. В приведенном примере внутренней координационной сферой является [Al(OH)4]-. Заряд аниона в этом случает компенсирует катион К+, находящиеся во внешней координационной сфере.
Классификация лигандов
В качестве лигандов выступают молекулы или ионы, содержащие донорные атомы (наиболее распространенные N, Р, О, галогены), способные отдавать комплексообразователю неподеленную электронную пару.
Число мест, занимаемых каждым лигандом во внутренней сфере комплексного соединения, называется координационной ёмкостью (дентатностью) лиганда. Она определяется числом электронных пар лиганда, которые участвуют в образовании координационной связи с центральным атомом.
По числу связей, образуемых лигандами с комплексообразователем, лиганды делятся на моно-, ди- и полидентатные::
1. К монодентатным относятся анионы F-, Сl-, Вг-, I-, H-, CN-, NO-, SCN- и т.д., нейтральные молекулы (NH3, амины, например, первичные RNH2 (R - органический радикал), молекулы воды и т.д.), имеющие только один донорный атом.
2. К бидентатным лигандам относятся молекулы или ионы, содержащие две функциональные группы, способные быть донором двух электронных пар. Например,
Молекула этилендиамина  Дианион щавелевой кислоты Дианион щавелевой кислоты | 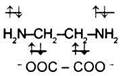 |
3. К полидентатным лигандам можно отнести 6-дентатный лиганд тетраанион этилендиаминтриуксусной кислоты (ЭДТА):