Направленность химических процессов
Химические процессы могут протекать самопроизвольно (без затрат энергии извне) и несамопроизвольно (требуют для своего осуществления затрат энергии). Направление, в котором самопроизвольно протекает химическая реакция, определяется совместным действием двух факторов:
1) стремлением системы к минимуму энергии (при Р = const - к минимуму энтальпии); 2) стремлением системы к достижению наиболее вероятного состояния, т.е. состояния, которое может быть реализовано наибольшим числом равновероятных способов (микросостояний, характеризующихся определенным
состоянием каждой частицы, входящей в состав системы).
Функцией состояния, одновременно отражающей влияние обеих упомянутых выше тенденций на направление протекания химических процессов, служит энергия Гиббса, связанная с энтальпией и энтропией соотношением
G = H – TS, (14)
где Т - абсолютная температура (К).
Энергия Гиббса имеет ту же размерность, что и энтальпия, и выражается, в джоулях (Дж) и килоджоулях (кДж).
Уравнение, отражающее связь возможности протекания химической реакции в системе с происходящими при этом изменениями Н и S, имеет вид:
ΔG0х.р. = ΔH0х.р – TΔS0х.р., (15)
где ΔG°х.р. — изменение стандартной энергии Гиббса химической реакции или просто стандартная энергия Гиббса химической реакции.
Как и в случае с ΔН, изменение энтропии ΔS0 х.р. и изменение энергии Гиббса ΔG0х. р. рассчитываются с использованием следствия закона Гесса (суммирование производят с учетом числа молей участвующих в реакции веществ):
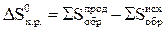 (16)
(16)
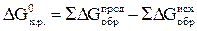 (17)
(17)
При постоянстве температуры и давления химические реакции могут протекать самопроизвольно только в таком направлении, при котором энергия Гиббса системы уменьшается (ΔG0х.р. < 0). Чем меньше ΔG0х.р., тем больше вероятность протекания данного процесса.
При ΔG0 х.р. > 0 реакция самопроизвольно не идет в прямом направлении, но возможно самопроизвольное протекание в обратном направлении. Таким образом, ΔG0 х.р., является критерием направленности химических процессов.
Если для какой-то реакции ΔН < 0 (экзотермическая реакция), а
ΔS > 0, то в соответствии с уравнением следует, что реакция может самопроизвольно протекать при любых температурах.
Если ΔН < 0 и ΔS < 0, то реакция возможна при условии, что член ΔН в уравнении для энергии Гиббса больше по абсолютному значению, чем член ТΔS; поскольку абсолютное значение члена ТΔS с ростом множителя Т увеличивается, то указанное условие будет действовать при достаточно низких температурах. Иначе говоря, при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций, даже если при этом энтропия системы уменьшается.
При высоких температурах наиболее вероятно протекание реакций, сопровождающихся возрастанием энтропии, в том числе и эндотермических.
Если ΔG0 х.р. = 0, то это соответствует термодинамическому условию равновесия в системе, откуда можно найти температуру, при которой наступит равновесие в системе:
Т = ΔН/ΔS. (18)
Для определения возможности протекания процесса при данных условиях надо определить знак ΔG0х.р..С этой целью в справочных таблицах термодинамических величин находятся стандартные значения ΔH0обр и ΔS0обр веществ, участвующих в реакции, по которым вычисляют ΔG0х.р. в соответствии с приведенной выше формулой.
Для расчета можно также использовать табличные значения ΔG0обр образования химических соединений, которые соответствуют изменению энергии Гиббса реакции образования 1 моль данного вещества в стандартном состоянии из простых веществ, также взятых в стандартных состояниях. Величины ΔG0обр образования простых веществ приняты равными нулю. Табличные значения стандартных величин ΔG0обр образования простых веществ приводятся для 25°С (298 К) и обозначаются ΔG0обр, с указанием соединения, к которому они относятся. Например: ΔG0обр Fe2O3(к) = -740,8 кДж/моль.
Пример 6.Можно ли получить металлический кадмий из сульфида кадмия (П) восстановлением оксида углерода (II) по реакции:
2CdS (к) + 2СО(г) = СО2(г) + CS2(г) + 2Cd(к).
Решение.
Ответ на вопрос задачи дает вычисление энергии Гиббса, рассматриваемой реакции. Проще всего воспользоваться табличными значениями энергии Гиббса образования соответствующих веществ:
ΔG0обр CdS = -153,16 кДж/моль;
ΔG0обр CO = -137,15 кДж/моль;
ΔG0обр CO2 = -394,37 кДж/моль;
ΔG0обр CS2 = 66,65 кДж/моль.
Вычисляем ΔG0 х.р. ( химической реакции) используя уравнение (17):
ΔG0 х.р = ΔG0обр CO2 + ΔG0обр CS2 – 2 ΔG0обр CdS - 2 ΔG0обр CO = -394,37 + 66,65 -- 2(-153,16) - 2(-137,15) = 252,88 кДж.
ΔG0 х.р. > 0, следовательно, данная реакция в стандартных условиях протекать не может и металлический кадмий таким способом получить нельзя.
Пример 7.Прямая или обратная реакция будут протекать при стандартных условиях в системе:
2NO2 (г) = 2NO (г) + О2(г), ΔН0х.р. = 113,2 кДж.
Решение.
Для ответа на этот вопрос следует вычислить ΔG0х.р. прямой реакции:
ΔG0х.р. = ΔН0х.р. - TΔS0 х.р., ΔН0х.р. по условию задачи известно, Т = 298К, так как условия стандартные. Следовательно, необходимо вычислить ΔS0 х.р , используя табличные значения энтропии соответствующих веществ:
S0 обр NO2 = 240,5 Дж/(моль·К);
S0 обр O2 = 205,0 Дж/(моль·К);
S0 обр NO = 210,6 Дж/(моль·К );
Используя уравнение (16) находим ΔS0х.р. :
ΔS0х.р. = 2 S0 обр NO + S0 обр O2 - 2 S0 обр NO2 = 2·210,6 + 205,0 - 2·240,5 = 145,2 Дж/К.
На основании уравнения (15) вычисляем ΔG0х.р., подставляя ΔН0х.р и ΔS0х.р., переводя при этом Дж в кДж:
ΔG0х.р. = 113,2 - 298 (145,2/1000) = 70,0 кДж.
ΔG0 х.р. > 0, следовательно, самопроизвольно в стандартных условиях может протекать только обратная реакция.
МЕТОДИКА ЭКСПЕРИМЕНТА
Основы калориметрии
Разработка методов экспериментального определения тепловых эффектов химических реакций, теплот фазовых превращений, теплот растворения и теплоемкостей составляет предмет калориметрии.
Основной частью калориметрических установок является калориметр (от лат. calor – тепло и …метр) – прибор для измерения количества теплоты, выделяющейся или поглощающейся в каком-либо физическом, химическом или биологическом процессе. Термин «калориметр» был предложен А. Лавуазье и П. Лапласом (1780), а прибор изобретен Хуго Юнкерсом. Это прибор, представляющий собой сосуд, наполненный жидкостью с известной теплоемкостью (калориметрическая жидкость), окруженный теплоизолирующей оболочкой (вместо калориметрической жидкости может быть использовано массивное твердое тело). Исследуемый процесс проводится так, чтобы теплота, выделяющаяся в реакции, быстро и, по возможности, полностью передавалась калориметрической жидкости (или отнималась от нее в эндотермических процессах). Основной измеряемой величиной является изменение температуры калориметрической жидкости (DТ). Зная теплоемкость калориметрической жидкости (С), можно легко рассчитать тепловой эффект реакции
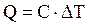
Если же теплота не полностью отдается калориметрической жидкости и часть ее идет на нагрев других частей калориметра, а также окружающей среды, то для расчетов используют не теплоемкость калориметрической жидкости, а величину, называемую константой калориметра (К). Эту величину определяют заранее, проводя в том же калориметре реакцию, тепловой эффект которой известен заранее с большой точностью. В этом случае
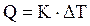
Типы калориметров
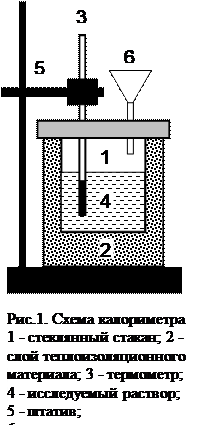 Калориметры можно разделить на две большие группы: с постоянной температурой и с переменной температурой калориметрической жидкости. Калориметры с переменной температурой бывают диатермическими (изотермическими) и адиабатическими. В первом случае строго учитывается теплообмен с калориметрической жидкостью. При адиабатическом способе измерения обычно калориметрической жидкостью является сама регулирующая система, например, раствор, теплоизолированный от окружающей среды. Этот способ и используют в данной работе (рис. 1).
Калориметры можно разделить на две большие группы: с постоянной температурой и с переменной температурой калориметрической жидкости. Калориметры с переменной температурой бывают диатермическими (изотермическими) и адиабатическими. В первом случае строго учитывается теплообмен с калориметрической жидкостью. При адиабатическом способе измерения обычно калориметрической жидкостью является сама регулирующая система, например, раствор, теплоизолированный от окружающей среды. Этот способ и используют в данной работе (рис. 1).
ТРЕБОВАНИЯ БЕЗОПАСТНОСТИ ТРУДА
При выполнении работы следует неукоснительно соблюдать правила работы в химической лаборатории.
Экспериментальная часть
