Химические связи атома углерода
Ковалентная связь – это химическая связь, образованная в результате обобществления электронов связываемых атомов.
σ-связь – ковалентная одинарная связь, которая образуется при перекрывании гибридных и негибридных АО с максимальным перекрыванием по прямой, соединяющей ядра атомов.
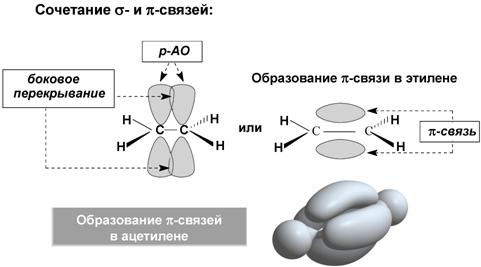
π-связь − ковалентная связь, которая образуется за счет бокового перекрывания негибридных p-атомных орбиталей с максимумом перекрытия по обе стороны от прямой, соединяющей ядра атомов.
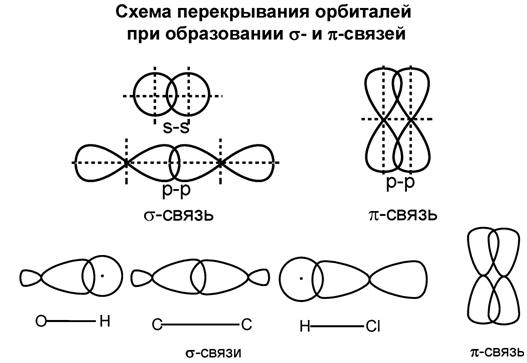
Схема перекрывания орбиталей при образовании σ-связей с участием атома углерода
Образование σ-связей в этане 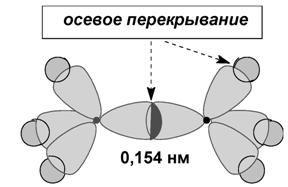 |
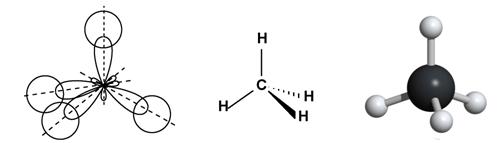 метан CH4 – тетраэдрическая молекула метан CH4 – тетраэдрическая молекула |
Кратные связи
Характеристики ковалентной связи
(длина, энергия, полярность, поляризуемость)
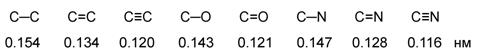 |
Длина связи – это расстояние между центрами связанных атомов.
Энергия связи – это энергия, которая выделяется при образовании связи или необходимая для разъединения двух атомов.
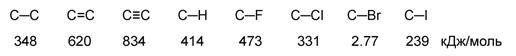 |
Сопряжение
Молекулы с чередующимися двойными π и простыми σ связями называют сопряженными системами.
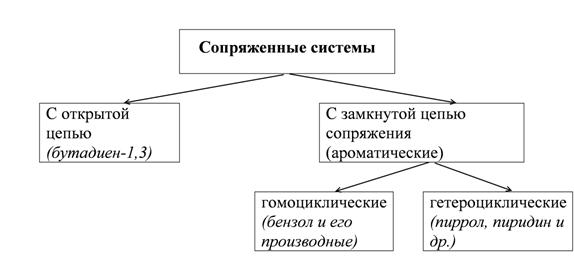
Сопряжение – это перераспределение электронной плотности в системе π – связей, приводящее к стабилизации молекулы.
Энергия сопряжения – это уменьшение энергии молекулы благодаря сопряжению.
Открытые системы сопряжения
Бутадиен-1,3, каждый из четырех углеродов в состоянии sp2-гибридизации, у каждого углерода – по одной свободной p-орбитали. В результате бокового перекрывания орбиталей происходит сопряжение двух локализованных двойных связей с образованием делокализованной четырехцентровой молекулярной орбитали. Этот вид сопряжения называют π-π-сопряжение. Есопряж. = 250 кДж/моль – 235 кДж/моль = 15 кДж/моль. Наблюдается выравненность электронных плотностей в результате делокализации электронов, создание единого электронного облака.
Делокализация электронов в циклических соединениях приводит к возникновению ароматических систем.
Правила ароматичности.
1. Наличие плоского цикла (кольца), состоящего из sp2-гибридизованных атомов, образующих σ-скелет (молекула копланарна).
2. Делокализация электронов, приводящая к образованию единого электронного облака (π-секстет).
3. Подчинение правилу Э. Хюккеля, т.е. электронное облако должно насчитывать (4n+2) π-электронов, где n=1,2,3,4…
4. Высокая степень термодинамической устойчивости (энергия сопряжения).
Гомоциклические ароматические системы.
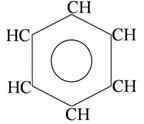 бензол n=1 6ē делокализовано в π- секстет бензол n=1 6ē делокализовано в π- секстет | 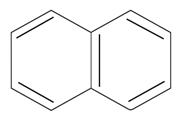 нафталин n=2 10ē делокализовано нафталин n=2 10ē делокализовано | |
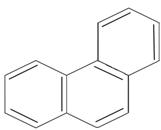 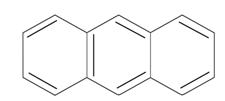 антрацен фенантрен n=3 14ē делокализовано антрацен фенантрен n=3 14ē делокализовано |
Бензол как прототип ароматических соединений
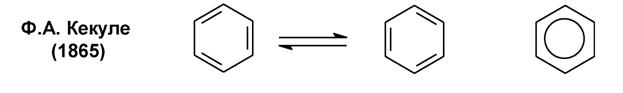
Бензол –плоский правильный шестиугольник с валентными углами 120º; все связи С-С равноценны (0,139 нм), и все атомы углерода sp2-гибридизованы; все связи С-С и С-Н лежат в одной плоскости.
