Элементы IIA подгруппы. Общая характеристика элементов. Степени окисления. Гидриды, оксиды.
Щё́лочноземе́льные мета́лл: бериллий, магний,кальций, стронций, барий и радий. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентныхэлектрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1 (у бериллия, крайне неустойчива)).Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре до600 °C. Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOHили NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.Гидриды щёлочноземельных (а также щелочных) металлов относятся к ионным (солеобразным) гидридам. Это белые кристаллические вещества, устойчивые в обычных условиях и лишь при нагревании разлагающиеся без плавления на металл и водород. Водой хорошо разлагаются с выделением водорода. Получаются при взаимодействииметаллов с водородом при температуре.
34. Элементы IA подгруппы. Щелочные металлы. Общая характеристика. Гидроксиды, пероксиды, супероскиды, гидроксиды (щелочи). Соли.
Щелочные металлы—очень мягкие, пластичные, легкоплавкие и легкие, как правило, серебристо-белого цвета; химически очень активны, сильные восстановители; бурно реагируют с водой, образуя щёлочи (откуда название). Наибольшие радиусы атомов. Восстановить сами металлы можно только эл. током.
Особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне.ГидроксидыДля получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли: 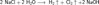 катод:
катод:  анод:
анод:  Прежде щёлочь получали реакцией обмена:
Прежде щёлочь получали реакцией обмена: 
Получаемая таким способом щёлочь была сильно загрязнена содой Na2CO3. Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами: 
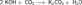
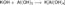 Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который при прокаливании разлагается на оксид и воду:
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который при прокаливании разлагается на оксид и воду: 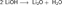 Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.Пероксиды- вещества, содержащие пероксогруппу -О-О- .В пероксидах кислород имеет степень окисления −1. Супероксиды — неорганические соединения, содержащие анион О2−, например, надпероксид калия КО2. Кислородные соединения, содержащие атомы О в степени окисления −1/2.Пероксиды и супероксиды проявляют свойства сильных окислителей:
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.Пероксиды- вещества, содержащие пероксогруппу -О-О- .В пероксидах кислород имеет степень окисления −1. Супероксиды — неорганические соединения, содержащие анион О2−, например, надпероксид калия КО2. Кислородные соединения, содержащие атомы О в степени окисления −1/2.Пероксиды и супероксиды проявляют свойства сильных окислителей:  Пероксиды и супероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
Пероксиды и супероксиды интенсивно взаимодействуют с водой, образуя гидроксиды: 
 Соли растворимы в воде. Малорастворимые в воде: LiF, Li2CO3(в производстве стекла), Li3PO4.NaHCO3-питьевая сода. Лимонокислый Li- для консервирования мяса и напитков. Соли К- удобрения (KNO3, KCl). Na2CO3*10H2O- кристаллическая сода. NaOH-каустическая сода(в пр-ве искусственных волокон, омыление жиров). LiOH-смазочное масло.KNaC4H4O6*4H2O-сегнетова соль(в радиоэлектронике).
Соли растворимы в воде. Малорастворимые в воде: LiF, Li2CO3(в производстве стекла), Li3PO4.NaHCO3-питьевая сода. Лимонокислый Li- для консервирования мяса и напитков. Соли К- удобрения (KNO3, KCl). Na2CO3*10H2O- кристаллическая сода. NaOH-каустическая сода(в пр-ве искусственных волокон, омыление жиров). LiOH-смазочное масло.KNaC4H4O6*4H2O-сегнетова соль(в радиоэлектронике).
35.Кислород. Общая харарктеристика элемента. Озон, свойства и применение. Вода. Пероксид водорода и его свойства (кислотные, окислительные и восстановительные).
Кислород —химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.Озон — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ с характерным запахом. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер.Озон — мощный окислитель. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.  Применение озона: для стерилизации изделий медицинского назначения,при получении многих веществ в лабораторной и промышленной практике, для отбеливания бумаги,для очистки масел, для очистки воды и воздуха от микроорганизмов (озонирование),для дезинфекции помещений и одежды, для озонирования растворов, применяемых в медицине. Озоновый слой- защита нашей планеты от УФ излучения (на высоте 22 км). Вода (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при стандартных условиях). Химическая формула: Н2O.Пероксид водорода: Н2О2-ковалентная полярная связь. -Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем.Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.При восстановлении Н2O2 образуется Н2O или ОН-, например:
Применение озона: для стерилизации изделий медицинского назначения,при получении многих веществ в лабораторной и промышленной практике, для отбеливания бумаги,для очистки масел, для очистки воды и воздуха от микроорганизмов (озонирование),для дезинфекции помещений и одежды, для озонирования растворов, применяемых в медицине. Озоновый слой- защита нашей планеты от УФ излучения (на высоте 22 км). Вода (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при стандартных условиях). Химическая формула: Н2O.Пероксид водорода: Н2О2-ковалентная полярная связь. -Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем.Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.При восстановлении Н2O2 образуется Н2O или ОН-, например: 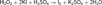 При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород: 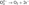 Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2: 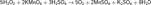 Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
