Атом, его составные части (ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
Атом, его составные части (ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
А́том— частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомное ядро́— центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Состоит из нуклонов – протонов(+) и нейтронов (0). Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами (наоборот – изотонами).Прото́н — элементарная частица, электрический заряд равен +1.Масса протона ~1 а.е.м. Ядро атома водорода состоит из одного протона.Нейтро́н —элементарная частица, не имеющая электрического заряда. Масса = 1 а.е.м.Электро́н— отрицательно заряженная элементарная частица. Из электронов состоят электронные оболочки атомов, где их число и положение определяет почти все химические свойствавеществ. Движение свободных электронов обусловливает такие явления, какэлектрический ток в проводниках и вакууме.Заряд равен −1,602176565(35)·10−19 Кл. Масса электрона равна 9,10938291(40)·10−28 г.Химическийэлемент— совокупность атомов с одинаковым зарядом ядра и числомпротонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе Менделеева. Формой существования химических элементов в свободном виде являются простые вещества. Порядковый номер элемента в ней равен заряду ядра, который, в свою очередь, численно равен числу содержащихся в ядре протонов. Суммарное число протонов и нейтронов в ядре равномассовому числу А. Количество протонов равно количеству электронов.Изото́пы— разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Пример изотопов: 168O (заряд ядра = 8, атомная масса = 16), 178O, 188O — три стабильных изотопа кислорода.
Периодический закон Д.И.Менделеева. Структура периодической системы: периоды, группы, подгруппы. Особенности электронного строения атомов главных и побочных подгрупп.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.Группа — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома. В короткопериодном варианте периодической системы группы подразделяются на подгруппы— главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Элементы одной подгруппы обладают сходными химическими свойствами.У атомов элементов главных подгрупп заполняются электронами последние уровни, а у побочных - предпоследние. Число электронов на последнем уровне у элементов главных подгрупп совпадает с номером их группы, у элементов побочных подгрупп – нет.
Изменение свойств элементов в периодической системе
см. п. 4
О связи элементов ПС элементов со строением атома смотри начало 4 билета
Ионные реакции.
Ионные реакции — реакции между ионами в растворе. Например, реакциюAgNO3 + NaCl = NaNO3 + AgClможно представить в ионном виде (реакция расписывается на ионы, не расписываются осадки, газы, вода, слабые кислоты и основания, а также малорастворимые и нерастворимые соединения) например AgCl нерастворим в воде и на ионы не расписывается:Ag+ + NO3− + Na+ + Cl− = AgCl + Na+ + NO3−Одинаковые ионы сокращаются и получается сокращенное ионное уравнение. Так как взаимодействие произошло между ионами Ag+ и ионами Cl−, то выражение Ag+ + Cl− = AgClи есть ионное уравнение рассматриваемой реакции. Оно проще молекулярного и в то же время отражает сущность происходящей реакции.
Условия необратимости ионной реакции: 1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.Молекулярное уравнение реакции щелочи с кислотой:  Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.Полное ионное уравнение реакции:K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.Cокращенное ионное уравнение реакции: H+ + OH– = H2O.Молекулярное уравнение реакции основного оксида с кислотой:CaO + 2HNO3 = Ca(NO3)2 + H2O.Полное ионное уравнение реакции:
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.Полное ионное уравнение реакции:K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.Cокращенное ионное уравнение реакции: H+ + OH– = H2O.Молекулярное уравнение реакции основного оксида с кислотой:CaO + 2HNO3 = Ca(NO3)2 + H2O.Полное ионное уравнение реакции:
 Cокращенное ионное уравнение реакции: CaO + 2H+ = Ca2+ + H2O.Молекулярное уравнение реакции нерастворимого основания с кислотой:3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2
Cокращенное ионное уравнение реакции: CaO + 2H+ = Ca2+ + H2O.Молекулярное уравнение реакции нерастворимого основания с кислотой:3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2  + 6H2O. Полное ионное уравнение реакции:
+ 6H2O. Полное ионное уравнение реакции:  В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.Молекулярное уравнение реакции амфотерного оксида с кислотой:Al2O3 + 6HCl = 2AlCl3 + 3H2O.Полное ионное уравнение реакции:Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O. Cокращенное ионное уравнение реакции:Al2O3 + 6H+ = 2Al3+ + 3H2O.
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.Молекулярное уравнение реакции амфотерного оксида с кислотой:Al2O3 + 6HCl = 2AlCl3 + 3H2O.Полное ионное уравнение реакции:Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O. Cокращенное ионное уравнение реакции:Al2O3 + 6H+ = 2Al3+ + 3H2O.
2. Если в результате реакции выделяется нерастворимое в воде вещество.Молекулярное уравнение реакции растворимой соли со щелочью:CuCl2 + 2KOH = 2KCl + Cu(OH)2  .Полное ионное уравнение реакции: Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2
.Полное ионное уравнение реакции: Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2  .
.
Cокращенное ионное уравнение реакции: Cu2+ + 2OH– = Cu(OH)2  . Молекулярное уравнение реакции двух растворимых солей:Al2(SO4)3 + 3BaCl2 = 3BaSO4
. Молекулярное уравнение реакции двух растворимых солей:Al2(SO4)3 + 3BaCl2 = 3BaSO4  + 2AlCl3.Полное ионное уравнение реакции:
+ 2AlCl3.Полное ионное уравнение реакции:  Cокращенное ионное уравнение реакции:
Cокращенное ионное уравнение реакции: 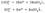
Молекулярное уравнение реакции нерастворимого основания с кислотой:Fe(OH)3 + H3PO4 = FePO4  + 3H2O. Полное ионное уравнение реакции:
+ 3H2O. Полное ионное уравнение реакции: 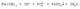 В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
3. Если в результате реакции выделяется газообразное вещество.Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:K2S + 2HCl = 2KCl + H2S  .Полное ионное уравнение реакции: 2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S
.Полное ионное уравнение реакции: 2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S  . Cокращенное ионное уравнение реакции: S2– + 2H+ = H2S
. Cокращенное ионное уравнение реакции: S2– + 2H+ = H2S  . Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
. Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2  Полное ионное уравнение реакции:
Полное ионное уравнение реакции: 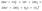 Cокращенное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:  О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:3СaCO3 + 2H3РO4 = Са3(PO4)2
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:3СaCO3 + 2H3РO4 = Са3(PO4)2  + 3H2O + 3CO2
+ 3H2O + 3CO2  Полное ионное уравнение реакции:
Полное ионное уравнение реакции: 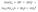 В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Элементы VIIА подгруппы.
Галогены - химические элементы 7-й группы периодической таблицы химических элементов Д.И. Менделеева. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается. Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.FClBrI--------->неметаллические свойства ослабевают, окислительная способность падает. Г2 + 2e --> 2Г-Физические свойства простых веществ - все галогены токсичны, плохо растворимы в H2O1VH2O – 2.3VCl2 (20°C)2F2 + 2H2O -->4HF + O2Cl2; Br2; J2 – подвергаются гидролизу (образуется хлорная, бромная либо йодная вода).Г2 + H2O<-->НГ + НГО
Химические свойства.F2 не реагирует с C; N2; O2Cl2 не реагирует с C; N2Галогеноводороды H2 + Г 2 --> 2НГ (синтез)HF – взрыв HCl – на светуHJ – при нагреванииCaF2 + H2SO4(конц)-->CaSO4 + 2HFNaCl + H2SO4 -->NaHSO4 + HCl(газ) NaCl + NaHSO4 -->Na2SO4 + HCl(газ)(дляJ; Br) РГ3 + H2O<--> 3НГ + H3PO4 НГ – растворяется в воде с образованием кислоты.HFHClHBrHJ ---------->(сила кислот увеличивается, устойчивость уменьшается, восстановительные свойства усиливаются)HClO – хлорноватистая (гипохлориты)HClO2 – хлористая (хлориты)HClO3 – хлорноватая (хлораты)HClO4 – хлорная (перхлораты) HClOHClO2HClO3HClO4--------------------->(окислительные свойства уменьшаются, сила кислот увеличивается)
Оксиды и гидроксиды.
CO2 + 2H2 -->C + 2H2O
CO2 + H2O <--> H2CO3
SiO2 + H2O --> (неидет)
SnO + H2SO4 --> SnSO4 +H2O
SnO + NaOH + H2O <--> Na[Sn(OH)3]
2SnO + O2 --> 2SnO2
Sn(OH)2 + 3HCl --> H[SnCl3] + 2H2O
Sn(OH)2 + NaOH --> Na[Sn(OH)3]
Pb(OH)2 + 2HCl --> PbCl2 + 2H2O
Pb(OH)2 + NaOH --> Na2[Pb(OH)4]
Pb(OH)2 + CO2 --> Pb2(OH)2CO3
Атом, его составные части (ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
А́том— частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомное ядро́— центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Состоит из нуклонов – протонов(+) и нейтронов (0). Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами (наоборот – изотонами).Прото́н — элементарная частица, электрический заряд равен +1.Масса протона ~1 а.е.м. Ядро атома водорода состоит из одного протона.Нейтро́н —элементарная частица, не имеющая электрического заряда. Масса = 1 а.е.м.Электро́н— отрицательно заряженная элементарная частица. Из электронов состоят электронные оболочки атомов, где их число и положение определяет почти все химические свойствавеществ. Движение свободных электронов обусловливает такие явления, какэлектрический ток в проводниках и вакууме.Заряд равен −1,602176565(35)·10−19 Кл. Масса электрона равна 9,10938291(40)·10−28 г.Химическийэлемент— совокупность атомов с одинаковым зарядом ядра и числомпротонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе Менделеева. Формой существования химических элементов в свободном виде являются простые вещества. Порядковый номер элемента в ней равен заряду ядра, который, в свою очередь, численно равен числу содержащихся в ядре протонов. Суммарное число протонов и нейтронов в ядре равномассовому числу А. Количество протонов равно количеству электронов.Изото́пы— разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Пример изотопов: 168O (заряд ядра = 8, атомная масса = 16), 178O, 188O — три стабильных изотопа кислорода.
