Термодинамические параметры химических процессов
Билет № 1
Строение атома
Модель строения атома:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов (нуклонов). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
4. Вокруг ядра по замкнутым орбитам вращаются электроны. Их число равно положительному заряду ядра.
Ядро - это центральная положительно заряженная часть атома, в которой сосредоточена его масса.
Электрон - частица с отрицательным зарядом, который условно принят за -1.
Нейтрон - нейтральная частица, не имеющая электрического заряда. Масса нейтрона равна 1 а. е. м.
Протон - положительно заряженная частица, с такой же массой, как и нейтрон. Заряд протона равен заряду электрона и противоположен по знаку.
Число протонов в ядре атома равно числу электронов. Это число определяет заряд ядра атома элемента и его порядковый номер элемента в таблице Менделеева.
Понятие о квантовой механике
Квантовая механика - раздел теоретической физики, описывающий квантовые системы и законы их движения.
Под квантовой механикой понимают физическую теорию динамического поведения форм излучения и вещества. Это теоретическая основа, на которой построена современная теория атомных ядер, атомов, физических тел, молекул и элементарных частиц. Вообще, квантовая механика была создана учеными, которые стремились понять строение атома. В течении многих годов легендарные физики изучали особенности и направления химии и следовали историческому времени развития событий.
Двойственная природа электрона
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой - его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определенном расстоянии от ядра.
Волновая функция
Шредингер, основываясь на постулате Де Бройля (Любая движущиеся частица обладает волновыми свойствами и может быть охарактеризована длиной волны и частотой), принципе неопределенности Гейзенберга (Невозможно одновременно с высокой степенью точности устанавливать координаты местоположения и величину скорости движения микрочастицы, для которой присущи корпускулярно-волновые свойства) и законе сохранения энергии электрона (е) в атоме составил уравнение и решил его для простейшего атома H. Решениями уравнения Шредингер являются энергии е в атоме и "волновые" функции, зависящие от координат. Волновая функция (ψi) не имеет определенного физического смысла, но квадрат волновой функции (ψi2) - это плотность вероятности нахождения е в точке с координатами (x,y,z) или плотность отрицательного заряда электронного облака в данной точке ψi2∙ dV - вероятность нахождения e в объеме dV.
Требования: волновая функция непрерывная, однозначная, ограниченная.
В результате точного решения уравнения Шредингера оказалось, что каждой волновой
функции соответствует набор 3х целочисленных параметров - n, l, m –
квантовых чисел. Шредингер рассчитал вероятность (W) нахождения е на
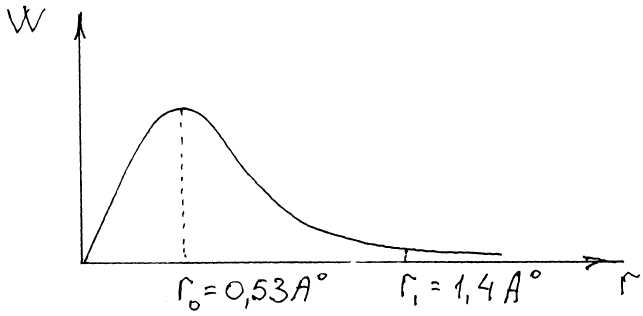
расстоянии r от ядра в основном состоянии атома водорода или, иначе,
распределение электронной плотности в атоме водорода в основном состоянии.
Билет № 2
Электронная плотность
Электронная плотность — плотность вероятности обнаружения электрона в данной точке пространства.
Пространственное распределение заряда электрона называется электронной плотностью. Исходя из того, что вероятность нахождения электрона в элементарном объеме dV равна |ψ|2dV, можно рассчитать функцию радиального распределения электронной плотности.
Если за элементарный объем принять объем шарового слоя толщиной dr на расстоянии r от ядра атома, тоdV = 4πr2dr,
а функция радиального распределения вероятности нахождения электрона в атоме (вероятности электронной плотности), равна: Wr = 4πr2|ψ|2dr
Характеристика состояния электрона системой квантовых чисел, их физический смысл
Главное квантовое число n характеризует энергию электронной орбитали. Главное квантовое число принимает значения 1, 2, 3, 4, 5, 6, 7…∞, обозначаемые также буквами K, L, M, N , O, P, Q … Чем больше n, тем выше энергия орбитали. Переходы электронов с одной орбитали на другую сопровождается излучением или поглощением квантов энергии.
Главное квантовое число характеризует также удаленность максимума электронной плотности от ядра. Чем больше n, тем больше объем орбитали. Совокупность электронов с одинаковым значением n называют энергетическим уровнем или оболочкой, слоем.
Орбитальное (побочное, азимутальное) квантовое число l принимает значения от 0 до (n-1) и характеризует форму граничной поверхности атомной орбитали. Обозначения: 0-s; 1-p; 2-d; 3-f и т.д. Совокупность электронов, имеющих одинаковые значения l и n, называют энергетическим подуровнем (подоболочкой). Граничная поверхность s-орбиталей имеет форму сферы (рис.4.1,а), р-орбиталей – гантели (рис.4.1,b-d). Граничные поверхности d-орбиталей показаны на рис.4.1,e-i. Форма граничных поверхностей f-орбиталей сложнее, чем d-орбиталей.
Орбитальное квантовое число характеризует также энергию электронов подуровня в пределах данного энергетического уровня.
Энергия подуровней возрастает в ряду s, p, d, f (Es<Ep<Ed<Ef).Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и может принимать целочисленные значения от +l до –l, включая 0. d-подуровень содержит пять орбиталей, s-подуровень – одну (рис.4.1,a), p-подуровень – три (рис.4.1,b-d), а f-подуровень – семь орбиталей.
Атомной орбиталью называют также волновую функцию, характеризуемую определенным набором трех квантовых чисел.
Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси и может принимать два значения - +1/2 и -1/2.
Билет № 3
Многоэлектроные атомы.
Атомы, у когорых происходит расщепление энергетических уровней ( атомы, начиная с n>=3)
Подуровни и уровни
Уровни: 1-2-3-4-5-6-7
Подуровни: s-p-d-f
Правило Клечковского
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа 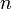 и побочного (орбитального) квантового числа
и побочного (орбитального) квантового числа 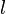 , т.е.
, т.е. 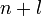 , имеет меньшее значение.
, имеет меньшее значение.
1.Первой заполняется АО с наим суммой (n+l). (n1+l1)<(n2+l2). E1<E2.
2.Если сумма (n+l) одинакова, первой заполняется АО с наименьшим значением n. (n1+l1)=(n2+l2). n1<n2. E1<E2
Нарушения правил Клечковского возможны. Проскок e характерен для: Cu, Cr, Ag, Nb, Ma, Ru, Rh, Pd, Au, Pt.
Правило Гунда(Хунда)
Электроны располагаются на орбиталях равной энергии таким образом, чтобы их суммарный спин был максимальный. Это означает, что первоначально электроны заполняют все свободные орбитали данного подуровня по 1-му, имея при этом параллельные спины, и только потом происходит заполнение этих орбиталей 2-ми электронами.
Билет № 4
Принцип Паули
В атоме не может быть 2 электрона, у которых 4 одинаковых квантовых числа. Следовательно, на 1-ой орбитали могут находиться не более 2-х электронов, отличающихся друг от друга значением спинового квантового числа.
Максимальное число электронов на уровнях и подуровнях
На 1 уровне максимальное количество электронов = 2
На 2 уровне максимальное количество электронов = 8
На 3 уровне максимальное количество электронов = 18
На 4 уровне максимальное количество электронов = 32
На 5 уровне максимальное количество электронов = 32
На 6 уровне максимальное количество электронов = 18
На 7 уровне максимальное количество электронов = 8
На s-подуровне максимальное количество электронов = 2
На p-подуровне максимальное количество электронов = 6
На d-подуровне максимальное количество электронов = 10
На f-подуровне максимальное количество электронов = 14
Билет № 5
Периодический закон Д.И.Менделеева
Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
Структура периодической системы
В периодической системе существуют горизонтальные и вертикальные ряды химических элементов.
Период – это горизонтальный ряд химических элементов, расположенные в порядке возрастания заряда атомного ядра. У химических элементов находящихся в одном периоде атомы имеют одинаковое количество энергетических уровней. Всего существует семь периодов. Различают малые и большие периоды химических элементов.
Малые периоды содержат один ряд химических элементов ( первый период – два элемента второй период – восемь элементов и третий период – то же восемь химических элементов).
Большие периоды содержат по два ряда химических элементов ( Четвертый период – восемнадцать элементов пятый период – восемнадцать элементов и шестой период – тридцать два химических элемента.
Каждый период начинается со щелочного металла и заканчивается инертным газом. Изменение свойств химических элементов в пределах периода называется горизонтальной периодичностью.
Группа – вертикальные ряды, химические элементы в которых имеют одинаковое количества электронов на внешнем энергетическом уровне.
Нахождение элемента в подгруппе определяется сходством конфигурации внешнего энергетического уровня. От порядка заполнения атомных орбиталей все элементы делятся на s,p,d и f семейства.
S и P химические элементы располагаются в главных подгруппах.
D элементы располагаются в побочных подгруппах.
F элементы – это химические элементы относящиеся к семейству актиноидов и лантаноидов а также побочной подгруппы третьей группы.
Связь Периодической системы со строением атома
Число протонов в ядре атома равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Билет № 6
Атомные и ионные радиусы, энергия ионизации, сродство к электрону, электроотрицательность; их связь с периодической системой Д.И.Менделеева
Атомные радиусы - характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах.
Под эффективным радиусом атома или иона понимается радиус сферы его действия, причем атом (ион) считается несжимаемым шаром. Используя планетарную модель атома, его представляют как ядро, вокруг которого по орбиталям вращаются электроны. Последовательность элементов в Периодической системе Менделеева соответствует последовательности заполнения электронных оболочек. Эффективный радиус иона зависит от заполненности электронных оболочек, но он не равен радиусу наружной орбиты. Для определения эффективного радиуса представляют атомы (ионы) в структуре кристалла как соприкасающиеся жесткие шары, так что расстояние между их центрами равно сумме радиусов. Атомные и ионные радиусы определены экспериментально по рентгеновским измерениям межатомных расстояний и вычислены теоретически на основе квантово-механических представлений.
Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал, представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества.
Билет № 7
Виды химической связи
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла.
Ковалентная связь
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
| Выделяют два механизма образования ковалентной связи: обменный («на паритетных началах») и донорно-акцепторный. В случае обменного механизма каждый из двух атомов, образующих связь, предоставляет по одному неспаренному электрону для общей электронной пары. В случае донорно-акцепторного механизма одна частица (донор) предоставляет собственную неподеленную электронную пару, а вторая частица (акцептор) — свободную орбиталь. |
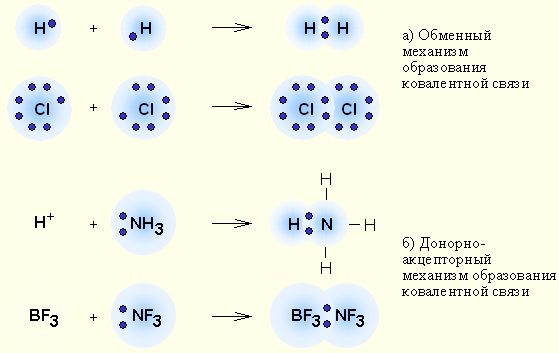
Билет № 8
Характеристика ковалентной связи: длина, энергия, полярность
Основные параметры ковалентных связей, которые определяют ее прочность и характер разрыва в реакциях, являются длина, полярность и энергия.
Длина связи – расстояние между центрами атомов, связанных ковалентной связью.
В пределах (слева направо) малых периодов длина связи какого-либо атома с другими уменьшается с увеличением заряда ядра атома. Внутри группы с увеличением заряд ядра длина связи возрастает (сверху вниз).
Чем больше разность ЭО элементов, тем больше полярность, тем меньше длина связи. В периодах полярность увеличивается слева направо. В группах длина связи сверху вниз увеличивается, что ведет к уменьшению прочности связи.
Полярные связи.
Если 2 одинаковых атома связаны ковалентной связью, то электронная плотность рапсределяется между обоими атомами равномерно CH3—CH3. Если атомы имеют разную электроотрицательность, то связывающая пара электронов будет располагаться ближе к более электрооотрицательному атому.
Электроотрицательность (ЭО) – способность атома притягивать электроны собственной электроотрицательной оболочкой. Чем больше ЭОэлемента, тем сильнее притяжение между ядром и внешним электроном.
Смещение электронной плотности ковалентной связи к более электронному атому называется полярной связью.
Полярность обозначается стрелками : → для σ связей и 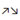 для π связей.
для π связей.
Символами δ и δ обозначаются частичные заряды на атомах.
δ+ δ- δ+ δ-
Пример: Н→ Cl Br→Cl
Степень разделения зарядов может быть охарактеризована дипольным моментом связи. Он соответствует величине разделенного заряда, умноженной на расстояние между атомами и измеряется в дебалях (D).
1 D = 10-18e*нм
Энергия связи.
Энергия, требуемая для разрыва ковалетной связи до двух нейтральных атомов, называется энергией диссоциации связи.(Е) кДж/моль
Чем больше энергия связи, тем прочнеее связь. Энергия, необходимая для разрыва ковалентной связи, равна количеству энергии, выделяющейся при образовании этой связи.
Свойства ковалентной связи: направленность, насыщаемость; валентные углы
Ковалентная связь обладает рядом важных свойств. К их числу относятся:насыщаемость и направленность.
Насыщаемость - характерное свойство ковалентной связи. Она проявляется в способности атомов образовывать ограниченное число ковалентных связей. Это связано с тем, что одна орбиталь атома может принимать участие в образовании только одной ковалентной химической связи. Данное свойство определяет состав молекулярных химических соединений. Так, при взаимодействии атомов водорода образуется молекула Н2, а не Н3. С точки зрения МВС третий атом водорода не может присоединиться, так как спин его электрона окажется параллельным спину одного из спаренных электронов в молекуле. Способность к образованию того или иного числа ковалентных связей у атомов различных элементов ограничивается получением максимального числа неспаренных валентных электронов.
Направленность - свойство ковалентной связи, определяющее геометрическую структуру молекулы. Причина направленности связи заключается в том, что перекрывание электронных орбиталей возможно только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания. В этом случае образуется наиболее прочная химическая связь.
Направление ковалентных связей характеризуется валентными углами - углами между линиями, соединяющими связываемые атомы. Графическая формула химической частицы не несет информации о валентных углах. Например, в сульфат-ионе SO42− валентные углы между связями сера−кислород равны 109,5o, а в тетрахлоропалладат-ионе [PdCl4]2− − 90o. Совокупность длин связей и валентных углов в химической частице определяет ее пространственное строение. Для определения валентных углов используют экспериментальные методы изучения структуры химических соединений. Оценить значения валентных углов можно теоретически, исходя из электронного строения химической частицы.
Билет № 9
Гибридизация
Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
Различные орбитали, не сильно отличающиеся энергиями, образуют соответствующее число гибридных орбиталей. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации. Гибридные орбитали одинаковы по форме электронного облака и по энергии. По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обуславливают лучшее перекрывание электронных облаков.
Типы гибридизации
Существуют множество типов гибридизаций: sp,sp2,sp3,sp2d,sp3d,sp3d2,sp3d3,sp3d4. Но чаще всех остальных используются только sp,sp2,sp3.
sp-гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов.
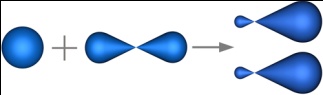 |
В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180°.
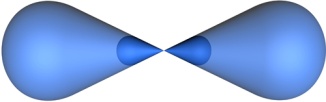 |
sp2-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов.
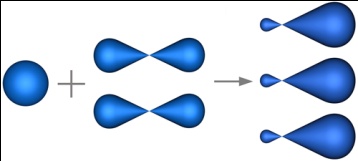 |
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу.
 |
sp3-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов.
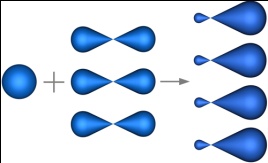 |
Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'.
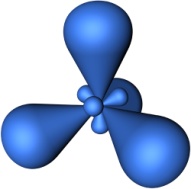 |
Билет № 10
Полярная и неполярная ковалентные связи
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: 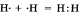 (на схеме электроны обозначены точками).
(на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
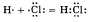 Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд , а на атоме водорода - частичный положительный. Таким образом, молекула становится полярной:
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд , а на атоме водорода - частичный положительный. Таким образом, молекула становится полярной: 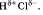
Эффективные заряды атомов в молекулах
Эффективный заряд атома , характеризует разность между числом электронов, принадлежащих данному атому в хим. соед., и числом электронов своб. атома. Для оценок Э. з. а. используют модели, в которых экспериментально определяемые величины представляют как ф-ции точечных неполяризуемых зарядов, локализованных на атомах; напр., дипольный момент двухатомной молекулы рассматривают как произведение Э. з. а. на межатомное расстояние. В рамках подобных моделей Э. з. а. можно рассчитать, используя данные оптич. или рентгеновской спектроскопии, ЯМР и др. Однако, поскольку электронная плотность в хим. соед. делокализована и границ между атомами не существует, нельзя описать разл. характеристики соед. одним набором Э. з. а.; значения этого показателя, определенные разными эксперим. методами, могут не совпадать. Э. з. а. можно определить также на основе квантовохим. расчетов.
Э. з. а., определенные в рамках к.-л. одной модели или в однотипных расчетах, используют для корреляции с различными физ.-хим. характеристиками соед., установления реакц. центров в молекулах, оценки степени ионности хим. связи.
Ионная связь, как крайний случай поляризации ковалентной связи
Предельным случаем ковалентной полярной связи является ионная связь. Если электроотрицательности атомов различаются очень сильно (например, атомов щелочных металлов и галогенов), то при их сближении валентные электроны одного атома полностью переходят на второй атом. В результате этого перехода оба атома становятся ионами и принимают электронную структуру ближайшего благородного газа. Например, при взаимодействии атомов натрия и хлора, они превращаются в ионы Na+ и Сl-, между которыми возникает электростатическое притяжение. Ионная связь может быть описана в рамках методов ВС и МО, однако обычно ее рассматривают с помощью классических законов электростатики.
Молекулы, в которых существует в чистом виде ионная связь, встречаются в парообразном состоянии вещества. Ионные кристаллы состоят из бесконечных рядов чередующихся положительных и отрицательных ионов, связанных электростатическими силами. При растворении ионных кристаллов или их плавлении в раствор или расплав переходят положительные и отрицательные ионы.
Следует отметить, что ионные связи обладают большой прочностью, поэтому для разрушения ионных кристаллов необходимо затратить большую энергию. Этим объясняется тот факт, что ионные соединения имеют высокие температуры плавления.
В отличие от ковалентной связи ионная не обладает свойствами насыщаемости и направленности. Причина этого состоит в том, что электрическое поле, создаваемое ионами, имеет сферическую симметрию и действует одинаково на все ионы. Поэтому количество ионов, окружающих данный ион, и их пространственное расположение определяются только величинами зарядов ионов и их размерами.
Билет № 11
Виды химической связи
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
Ионная связь, её свойства, отличие от ковалентной связи
Предельным случаем ковалентной полярной связи является ионная связь. Если электроотрицательности атомов различаются очень сильно (например, атомов щелочных металлов и галогенов), то при их сближении валентные электроны одного атома полностью переходят на второй атом. В результате этого перехода оба атома становятся ионами и принимают электронную структуру ближайшего благородного газа. Например, при взаимодействии атомов натрия и хлора, они превращаются в ионы Na+ и Сl-, между которыми возникает электростатическое притяжение. Ионная связь может быть описана в рамках методов ВС и МО, однако обычно ее рассматривают с помощью классических законов электростатики.
Молекулы, в которых существует в чистом виде ионная связь, встречаются в парообразном состоянии вещества. Ионные кристаллы состоят из бесконечных рядов чередующихся положительных и отрицательных ионов, связанных электростатическими силами. При растворении ионных кристаллов или их плавлении в раствор или расплав переходят положительные и отрицательные ионы.
Следует отметить, что ионные связи обладают большой прочностью, поэтому для разрушения ионных кристаллов необходимо затратить большую энергию. Этим объясняется тот факт, что ионные соединения имеют высокие температуры плавления.
В отличие от ковалентной связи ионная не обладает свойствами насыщаемости и направленности. Причина этого состоит в том, что электрическое поле, создаваемое ионами, имеет сферическую симметрию и действует одинаково на все ионы. Поэтому количество ионов, окружающих данный ион, и их пространственное расположение определяются только величинами зарядов ионов и их размерами.
Металлическая связь
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна для металлов, сплавов и интерметаллических соединений.
Так как металлы являются кристаллическими веществами, число валентных электронов атома металла недостаточно для образования связей со всеми его соседями (так как соседей много). Поэтому в металлах небольшое число электронов одновременно связывает большое число атомных ядер, а сами электроны могут перемещаться в металле. Иначе говоря, в металлах имеет место сильно делокализованная химическая связь.
Согласно одной из теорий металл можно рассматривать как плотно упакованную структуру из положительно заряженных ионов, связанных друг с другом коллективизированными электронами (электронный газ). Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность металла.
Вследствие нелокализованности металлической связи для ее описания лучше всего подходит теория кристаллических орбиталей.
Билет № 12
Межмолекулярное взаимодействие. Природа межмолекулярных взаимодействий. Виды межмолекулярного взаимодействия
Межмолекулярное взаимодействие — взаимодействие, не приводящее к разрыву или образованию новых химических связей. Силы притяжения, действующие между молекулами на больших расстояниях (от 5-8 до 100 Å), называются силами Ван-дер-Ваальса и представляют собой кулоновские силы, возникающие между электронами и ядрами двух молекул.
При небольшом смещении отрицательных и положительных зарядов в нейтральной молекуле она перестает быть неполярной, превращаясь в электрический диполь. Имеютсямолекулы, обладающие постоянным электрическим дипольным моментом и называющиесяполярными. При сближении они стремятся развернуться так, чтобы их обращенные друг к другу стороны были заряжены разноименно. В этом случае суммарная сила притяжения между зарядами больше, чем суммарная сила отталкивания, поэтому полярные молекулы притягиваются. Эти электростатические силы иногда называют дипольно-ориентационными.
Если молекулы не имеют постоянного дипольного момента, то при помещении во внешнее электрическое поле они его приобретают. Во внешнем электрическом поле положительные заряды молекулы несколько смещаются в направлении поля, а отрицательные – впротивоположном направлении. Поляризация может быть обусловлена также деформацией электронной оболочки неполярной молекулы под влиянием электрического поля полярной(индуцированный диполь), что всегда приводит к понижению энергии системы и притяжению молекул. Такие силы межмолекулярного взаимодействия называют поляризационными (индукционными). Межмолекулярное взаимодействие может быть связано также с переносом электронного заряда с одной молекулы на другую. Перенос заряда происходит при перекрывании электронных оболочек молекул, если их сродство к электрону различно. Перенос заряда можно рассматривать как предельный случай поляризации.
При сближении неполярных молекул электрические поля составляющих их зарядов быстро меняются во времени и лишь в среднем компенсируют друг друга в различных точках пространства. Поэтому при сближении молекулы поляризуют друг друга, причем обращенные друг к другу стороны поляризованных молекул обладают зарядами противоположного знака.
В результате взаимно поляризованные молекулы притягивают друг друга. Такие силы межмолекулярного взаимодействия называются дисперсионными (лондоновскими). Они действуют между любыми атомами и молекулами независимо от их строения.
Таким образом, различают три вида сил Ван-дер-Ваальса: электростатические (дипольно-ориентационные), поляризационные (индукционные) и дисперсионные.
Водородная связь
Водородная связь возникает между молекулами, в которых атом водорода связан с атомом элемента, обладающего высокой электроотрицательностью. Так, атом водорода, образующий в молекуле НХ прочную ковалентную связь с атомом X, может образовывать водородную связь с атомом X (или Y) другой молекулы. Водородную связь принято изображать пунктиром: X - Н …У. Обычно энергия водородной связи (8-80 кДж/моль) значительно уступает энергии химической связи, но намного больше энергии ван-дер-ваальсова взаимодействия (1-5 кДж/моль). Исключением является сильная водородная связь в ионе (FHF) (250 кДж/моль).
Возникновение водородной связи обусловлено двумя причинами:
1. Атом водорода, связанный полярной ковалентной связью с атомом X, фактически не имеет электронов и способен легко внедряться в электронные облака других частиц.
2. Обладая вакантной s-орбиталью, атом водорода может принимать неподеленную электронную пару атома Y, образуя с ним донорно-акцепторную связь.
Билет № 13
Конденсированное состояние вещества
Конденсированное состояние вещества(конденсированное тело) - понятие, объединяющее твёрдые тела и жидкости в противопоставлении их газу. Атомные частицы (атомы, молекулы, ионы) в конденсированном теле связаны между собой. Ср. энергии теплового движения частиц не хватает на самопроизвольный разрыв связи, поэтому конденсированное тело сохраняет свой объём.
