Скорость химических реакций. Химическое равновесие.
Тезисы лекции:
Скорость химических реакций и связанный с ней механизм их протекания изучает химическая кинетика. При определении скоростей учитывается, что реакции могут быть гомогенными или гетерогенными. Гомогенные реакции протекают во всем объеме системы, а гетерогенные – только на поверхности раздела фаз. Скорость последних реакций измеряется количеством вещества системы, вступающего в реакцию за единицу времени на единицу поверхности раздела фаз.
Скорость гомогенных реакций измеряется количеством вещества системы, вступающего в реакцию или образующегося в результате реакции за единицу времени на единицу объема:
υ = 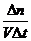 . Так как
. Так как 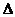 n/V- изменение молярной концентрации
n/V- изменение молярной концентрации 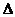 с, то средняя скорость υ за отрезок времени
с, то средняя скорость υ за отрезок времени 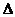 t равна отношению
t равна отношению 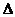 с/
с/ 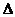 t. Если
t. Если 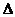 t стремится к нулю, то в пределе средняя скорость становится скоростью в данный момент времени или истинной скоростью, которая равна производной от концентрации по времени: υ =
t стремится к нулю, то в пределе средняя скорость становится скоростью в данный момент времени или истинной скоростью, которая равна производной от концентрации по времени: υ = 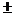 dc/dt. Знак определяется направлением изменения концентрации вещества: плюс означает ее увеличение, а минус – уменьшение.
dc/dt. Знак определяется направлением изменения концентрации вещества: плюс означает ее увеличение, а минус – уменьшение.
Скорость химической реакции зависит от: 1)природы реагирующих веществ; 2)условий, при которых протекает реакция, - концентраций реагирующих веществ, температуры, давления (для газов), облучения квантами света и др.; 3)присутствия катализаторов.
Зависимость скорости реакции от концентрации дается законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Для реакции mA + nB 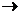 ее скорость, согласно закону действующих масс, выражается равенством υ = k[A]m[B]n, где k – коэффициент пропорциональности, который называется константой скорости химической реакции. Константа скорости зависит от температуры и природы реагирующих веществ, но не от их концентраций.
ее скорость, согласно закону действующих масс, выражается равенством υ = k[A]m[B]n, где k – коэффициент пропорциональности, который называется константой скорости химической реакции. Константа скорости зависит от температуры и природы реагирующих веществ, но не от их концентраций.
Скорость реакции возрастает при увеличении концентрации всех исходных веществ, а при увеличении концентрации только одного из них возрастает в том случае, если это вещество имеет больший стехиометрический коэффициент в кинетическом уравнении данной реакции.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 100, для большинства реакций, скорость возрастает приблизительно в 2-4 раза.
Увеличение скорости с повышением температуры объясняется увеличением числа так называемых активных молекул, т.е. молекул, обладающих достаточной энергией для осуществления химического взаимодействия при их столкновении. Та минимальная избыточная энергия по сравнению со средней энергией, которой должны обладать молекулы, чтобы реакция между ними стала возможной, называется энергией активации. Преодоление этого энергетического барьера частицами исходных веществ связано с образованием активных комплексов, которые затем превращаются в продукты реакции за счет разрыва старых связей и образования новых.
Разница между средней энергией молекул продуктов реакции и молекул исходных веществ определяет тепловой эффект реакции.
Правило Вант-Гоффа – эмпирическое, входит в пределы, определенные уравнением Аррениуса, которое, в свою очередь, описывает общее уравнение зависимости k(T) и имеет вид
k = Ае 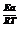 е
е 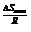 , где е
, где е 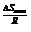 - величина, определяющая влияние стерического фактора на скорость реакции, а е
- величина, определяющая влияние стерического фактора на скорость реакции, а е 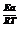 - показывает влияние температуры на скорость реакции.
- показывает влияние температуры на скорость реакции.
Ускорить химическую реакцию можно и действием катализаторов – веществ, которые изменяют скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливают свой химический состав после каждого цикла взаимодействия. Действие катализаторов: 1) не изменяет теплового эффекта реакции; 2) снижает энергию активации как прямой, так и обратной реакции на одну и ту же величину, поэтому не смещает равновесия; 3) увеличивая в одинаковой степени скорости прямой и обратной реакций, сокращает время достижения равновесия; 4) является избирательным, что определяется природой катализатора и условиями его применения. Механизм гомогенного катализа состоит в том, что конечный продукт реакции АВ в присутствии катализатора К образуется не за счет непосредственного взаимодействия исходных веществ А и В, согласно уравнению А+В 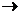 АВ, а в результате реакции, протекающей в две стадии: А+К
АВ, а в результате реакции, протекающей в две стадии: А+К 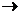 А…К
А…К 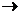 АК и АК+В
АК и АК+В 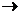 АК…В
АК…В 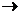 АВ+К. Таким образом, катализатор остается неизменным, а скорость реакции увеличивается за счет снижения энергии активации.
АВ+К. Таким образом, катализатор остается неизменным, а скорость реакции увеличивается за счет снижения энергии активации.
Состояние системы, когда в ней протекают два противоположно направленных процесса с одинаковой скоростью, называют химическим равновесием. Каждое химическое равновесие устанавливается при определенном значении трех параметров, которые его характеризуют: 1) концентрация реагирующих веществ; 2) температура и 3) давление для газов. Изменение одного из этих параметров определяет характер внешнего воздействия на систему и приводит к нарушению равновесия. Направление смещения равновесия определяется правилом Ле Шателье, согласно которому если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то в системе возникает противодействие.
Основная литература:1-6
Дополнительная литература:11, 12, 14, 16, 17-30
Тема лекции:
