Скорость химических реакций. Химическое равновесие
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема (в гомогенной реакции) или на единицу площади поверхности раздела фаз (для гетерогенных реакции).
В случае гомогенного процесса, протекающего при постоянном объеме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени.
Скорость зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул и атомов), зависимость скорости реакции от концентрации определяется. Законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Так, для реакции типа А + В 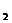
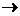 АВ
АВ 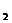 закон действующих масс выражается следующим образом:
закон действующих масс выражается следующим образом:
V = k [A] × [B 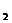 ] .
] .
В этом уравнении [A] и [B 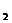 ] - концентрации вступающих в реакцию веществ, k - константа скорости реакции, значение которой зависит от природы реагирующих веществ.
] - концентрации вступающих в реакцию веществ, k - константа скорости реакции, значение которой зависит от природы реагирующих веществ.
ПРИМЕР 1. Написать выражения закона действия масс для реакций:
а) 2 NO (г) + Cl 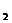 (г)
(г)  2NOCl (г),
2NOCl (г),
в) CaCO 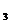 (к)
(к)  СаО (к) + СО
СаО (к) + СО 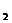 (г) .
(г) .
Решение:
а) V= к[NO] × [Cl 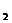 ].
].
б) Поскольку карбонат кальция - твердое вещество, концентрация которого не изменяется в ходе реакции, искомое выражение будет иметь вид: V = к, т.е. в данном случае скорость реакции при определенной температуре постоянна.
Зависимость скорости реакции (или константы скорости) от температуры может быть выражено уравнением:
V 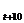 / V
/ V 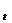 = k t+10/ k t = g.
= k t+10/ k t = g.
Здесь V 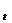 и k
и k 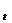 - скорость и константа скорости при температуре t, а два других члена уравнения относятся к скорости и константе скорости при температуре (t+10 ) К; g- температурный коэффициент скорости реакции значение которого для большинства реакций лежит в пределах от 2 до 4 (правило Вант Гоффа).
- скорость и константа скорости при температуре t, а два других члена уравнения относятся к скорости и константе скорости при температуре (t+10 ) К; g- температурный коэффициент скорости реакции значение которого для большинства реакций лежит в пределах от 2 до 4 (правило Вант Гоффа).
ПРИМЕР 2. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 75  C?
C?
Решение. Поскольку разность температур 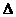 t = 55
t = 55  С, то, обозначив скорость реакции при 20 и 75
С, то, обозначив скорость реакции при 20 и 75  С соответственно через V и V
С соответственно через V и V  , получим:
, получим:
V  / V55/10 = 2,8 = 2,85.5 = 287 .
/ V55/10 = 2,8 = 2,85.5 = 287 .
Это значит, что скорость реакции увеличится в 287 раз при подъеме температуры на 55 градусов.
При изменении условий протекания реакции скорости прямого и обратного процессов в обратимых реакциях изменяются неодинаково, химическое равновесие нарушается. Процесс перехода от одного равновесного состояния к новому равновесному состоянию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье:
Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено.
Так, повышение температуры проводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. охлаждением системы; повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведет к смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных веществ приводит к сдвигу равновесия в направлении обратной реакции.
РЕШИТЬ САМОСТОЯТЕЛЬНО ЗАДАЧИ 31-36
Лабораторная работа № I
Изучение свойств водорода
Цель работы
1. Познакомиться с электронным строением атома водорода, молекулы 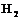 ,
, 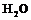 ,
, 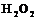 .
.
2. Изучить реакции получения водорода в лабораторных условиях.
3. Изучить окислительно-восстановительные реакции на примере взаимодействия йодида калия и перманганата калия с перекисью водорода.
2. Контрольные вопросы
1. Как получают водород в промышленности ив лаборатории? Привести уравнения реакций.
2. Описать строение молекулы водорода.
3. Описать строение молекулы воды.
4. Указать способы получения пероксида водорода. Описать строение молекулы 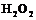 .
.
5. Какие реакции называются окислительно-восстановительными? Дайте определения окислителям и восстановителям.
6. Какие степени окисления может принимать водород в реакциях?
7. До каких продуктов может быть окислена вода:
а) до О2 и 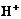 ; б) до
; б) до 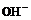 и Н2; в) до
и Н2; в) до 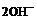 ?
?
8. Составить уравнения полуреакций окисления и восстановления для следующих реакций и определить, в каких случаях водород служит окислителем, а в каких – восстановителем:
а) 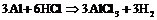 ;
;
б) 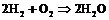 ;
;
в) 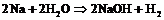 ;
;
г) 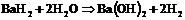 .
.
Содержание работы и методические указания к ее выполнению
На «рабочем столе» ПК найдите значок программы «1C: Химия». После загрузки программы, найдите вкладку «Альбом» / «Водород».
1. Изучить строение атома водорода, молекулы 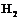 ,
, 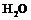 ,
, 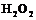 .
.
1.1. Зарисовать атом водорода.
1.2. Зарисовать электронное строение, геометрию и структуру молекулы водорода.
1.3. Зарисовать геометрию и структуру молекулы перекиси водорода.
1.4. Зарисовать электронное строение, геометрию и структуру молекулы воды.
1.5. Перечислите изотопы водорода.
1.6. Зарисовать структуру льда, изучить водородные связи.
