Газовые смеси. Закон Дальтона
Парциальным давлением называется та часть общего давления газовой смеси, которая обусловлена данным газом или паром. Парциальное газа в смеси равно тому давлению газа в смеси, которым он обладал бы один, занимая такой же объём, какой занимает смесь при той же температуре.
Закон Дальтона.При отсутствии химических реакций общее давление газовой смеси Робщ равно сумме парциальных давлений всех входящих в неё газов р1, р2, р3 …,рn:
Робщ = р1 + р2 + … + рn . (62)
Парциальное давление данного газа пропорционально доле его молекул от общего количества молекул смеси (мольной доле):
pi = Pобщ·Xi = Pобщ· 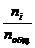 . (63)
. (63)
Мольная доля Хi – есть отношение числа молей данного вещества – ni (или определённого вида частиц) к общему числу молей вещества (или частиц), находящихся в системе ni.
Мольную долю можно относить либо ко всей системе, либо к какой-то фазе. В последнем случае берётся отношение числа молей данного вещества в этой фазе к общему числу молей вещества, образующих данную фазу. Сумма мольных долей всех веществ, образующих систему (или фазу), равна единице.
Состав газовых смесей можно выразить также с помощью весовых, объёмных частей. Весовой долей данного газа в смеси называется отношение массы этого газа к массе газовой смеси. Если обозначим весовые доли газов через G1, G2, G3, …, Gi; а массы газов в смеси – через m1, m2, m3, …, mi и общую массу газовой смеси – через m, то тогда получаем:
G1 = 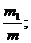 G2 =
G2 = 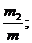 G3 =
G3 = 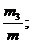 … Gn =
… Gn = 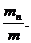 (64)
(64)
Но
G1 + G2 + G3 + … + Gn =1
и
m1 + m2 + m3 + … + mn = m.
Чтобы выразить состав газовой смеси в объёмных единицах, необходимо объёмы газов, составляющих смесь, привести к одному давлению и одной температуре. Объём отдельного газа, входящего в состав смеси, приведённого к давлению смеси, называется приведённым объёмом. Для того, чтобы найти приведённый объём газа при давлении газовой смеси Робщ и температуре Т, необходимо воспользоваться законом Бойля - Мариотта:
p1Vобщ = v1Pобщ; p2Vобщ = v2Pобщ; p3Vобщ = v3Pобщ; … ; pnVобщ = vnPобщ,
где v1, v2, v3, …, vn – приведённые объёмы отдельных газов, составляющих смесь; р1, р2, р3, …, рn – парциальные давления отдельных газов;
v1 = 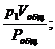 v2 =
v2 = 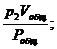 v3 =
v3 = 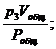 …; vn =
…; vn = 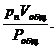 (65)
(65)
Сумма приведённых объёмов отдельных газов равняется общему объёму смеси:
v1 + v2 + v3 + … + vn = Vобщ.
Отношение приведённых объёмов отдельных газов к общему объёму смеси называется объёмной долей и выражается через r:
r1 = 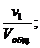 r2 =
r2 = 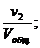 r3 =
r3 = 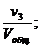 …; rn =
…; rn = 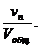 (66)
(66)
Для газовых смесей состав, выраженный объёмными и мольными долями одинаков, т.е.:
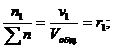
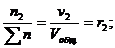
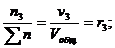 …;
…; 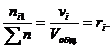 (67)
(67)
Среднюю молекулярную массу газовой смеси, если известны объёмные доли газов в смеси, вычисляем по формуле:
Мср = М1r1 + M2r2 + M3r3 + … + Mnrn. (68)
Пример 7. Приведите к нормальным условиям газ (вычислите объём V, который занимает данное количество газа при 273 К и 1,0133·105Па), если при 373 К и 1,333·103 Па его объём равен 3·10-2м3.
Решение. По уравнению (59) определяем объём газа:
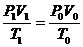
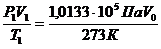
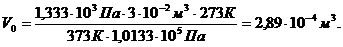
Пример 8. Газ под давлением 1,2·105 Н/м2 занимает объём 4,5 л. каково будет давление, если, не изменяя температуры, увеличить объём до 5,5 л?
Решение. Используя закон Бойля – Мариотта (52):
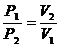 ,
,
откуда получаем
Р2 = 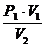 ,
,
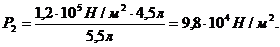
Пример 9. Вычислите парциальные объёмы водяного пара, азота и кислорода и парциальные давления азота и кислорода во влажном воздухе. Общий объём смеси 2·10-3 м3, общее давление 1,0133·105 Па, парциальное давление паров воды 1,233·104 Па. Объёмный состав воздуха 21% О2 и 79% N2,
Решение. Вычисляем парциальный объём паров воды V 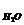 по уравнению (65):
по уравнению (65):
 vn =
vn = 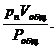
V 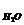 =
= 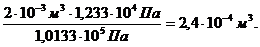
Вычисляем парциальные объёмы О2 и N2:
V 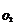 + V
+ V 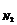 = V - V
= V - V 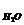 = 0,002 – 0,00024 = 1,76·10-3м3.
= 0,002 – 0,00024 = 1,76·10-3м3.
V 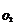 / V
/ V 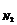 = 0,21/0,79.
= 0,21/0,79.
Отсюда
V 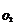 = 1,76·10-3м3 · 0,21 = 0,37·10-3м3;
= 1,76·10-3м3 · 0,21 = 0,37·10-3м3;
V 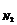 = 1,76·10-3м3 · 0,79 = 1,39·10-3м3.
= 1,76·10-3м3 · 0,79 = 1,39·10-3м3.
Вычисляем парциальное давление О2 по уравнению (63):
Р 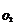 = Р· х
= Р· х 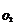 ,
,
х 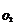 = V
= V 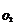 / V = 0,37·10-3м3/ 2·10-3м3 = 0,186;
/ V = 0,37·10-3м3/ 2·10-3м3 = 0,186;
Р 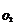 = 1,0133·105 Па· 0,186 = 1,866 · 104 Па;
= 1,0133·105 Па· 0,186 = 1,866 · 104 Па;
а так как Р = Р 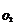 + Р
+ Р 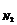 + Р
+ Р 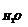 , то
, то
Р 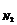 = 1,0133·105 Па - 1,866 · 104 Па - 1,233·104 Па = 7,033·104 Па.
= 1,0133·105 Па - 1,866 · 104 Па - 1,233·104 Па = 7,033·104 Па.
Вариант 1.
5. При нормальных условиях плотность двуокиси углерода 1,977кг/м3. Каким давлением нужно сжать газ, чтобы плотность его при 0ºС достигла 10 кг/м3?
6. Газовая смесь состоит из 3 м3 СО2, взятой при давлении 95 940 Н/м2, 4 м3 О2 при давлении 106 600 Н/м2, 6 м3 N2 при давлении 93280 Н/м2. Объём смеси 10 м3. Определить парциальные давления газов в смеси и общее давление смеси (температура постоянна).
Вариант 2.
5. Масса 1 м3 азота при 10ºС и давлении 9,86·104 Н/м2 равна 1,175 кг. Какова масса этого же объёма азота под давлением 1,092·105 Н/м2 при той же температуре?
6. Сухой воздух имеет примерно следующий состав (об.%): N2 78,09; О2 20,95; Ar 0,93; СО2 0,03 %. Определить массу 40 м3 сухого воздуха при 22ºС и нормальном давлении.
Вариант 3.
5. При 37ºС объём газа равен 0,50 м3. Какой объём займёт газ при 100ºС, если давление останется постоянным?
6. Газовая смесь приготовлена из 3 л СН4 при давлении 95 940 Н/м2; 4 л Н2 при давлении 83 950 Н/м2 и 1 л СО при давлении 108 700 Н/м2. Объём смеси равен 8 л. определить парциальные давления газов в смеси и общее давление смеси.
Вариант 4.
5. При 18ºС давление в баллоне с азотом 1,621·106 Н/м2. При какой температуре давление возрастёт в два раза?
6. Рассчитать общее давление газов в сосуде ёмкостью 200 л, если в нём при 135ºС содержится смесь 82,1 г бензола и 23,6 г толуола.
Вариант 5.
5. Вычислить объём дымовых газов при нормальном давлении, если их объём при давлении 9,888·104 Н/м2 и постоянной температуре равен 10м3?
6. Колошниковый газ имеет примерный состав (об.%): СО 28; Н2 3; СО2 10; N2 59. вычислить парциальные давления составляющих смесь газов, если общее давление газовой смеси 106 400 Н/м2.
Вариант 6.
5. Под каким давлением находится кислород, если плотность его при 0ºС равна 6,242 кг/м3? Плотность кислорода при н.у. 1,429 кг/м3.
6. Газ подземной газификации имеет примерно следующий состав (об.%): СО 12; Н2 14; N2 62,2; СО2 10 и СН4 1,8. Определить состав данной смеси газов в весовых процентах.
Вариант 7.
5. Давление кислорода в баллоне при 15ºС равно 1,255·107 Н/м2. На сколько понизится давление газа, если охладить баллон до -33ºС?
6. Генераторный газ имеет приблизительно следующий состав (вес.%): СО2 12; Н2 14; СО 20; N2 54. Вычислить содержание каждой составной части генераторного газа по объёму.
Вариант 8.
5. Сколько кубических метров двуокиси углерода при 22ºС и99289 Н/м2 можно получить при обжиге 1000 кг известняка с содержанием 90% СаСО3?
6. В баллоне ёмкостью 20 л при 18ºС находится смесь 28 г кислорода и 24 г аммиака. Определить парциальные давления каждого из газов и общее давление смеси.
Вариант 9.
5. Определить давление, под которым будут находиться 13,5 г окиси углерода в сосуде ёмкостью 8 л при 150ºС?
6. Рассчитать общее давление газовой смеси, состоящей из 40 г этилена и 30 г метана и находящейся в сосуде ёмкостью 100 л при 25ºС.
Вариант 10.
5. Наивысшая температура в газгольдере летом 40ºС, наименьшая зимой - -30ºС. На сколько больше (по массе) метана может вместить газгольдер ёмкостью 2000 м3 зимой, чем летом при нормальном давлении?
6. В сосуде ёмкостью 2 л находится 5,23 г азота и 7,10 г водорода. вычислить общее давление смеси газов при 25ºС.
ФАЗОВЫЕ РАВНОВЕСИЯ
Основные понятия и определения
Фазой называется совокупность однородных частей системы (т.е. одинаковых по физическим, химическим и термодинамическим свойствам), отделённая от других частей системы физической (реально существующей) поверхностью раздела. Индивидуальное вещество в твёрдом агрегатном состоянии всегда образует самостоятельную фазу.
Жидкие и твёрдые фазы называются конденсированными.
Если вещество содержится одновременно в разных фазах, то происходит его переход из одной фазы в другую; такой переход называется фазовым. Состояние, при котором скорости противоположных фазовых переходов равны, называется фазовым равновесием.
Компонентами (составляющими веществами) называются все химические вещества, которые могут быть выделены из системы и существовать вне её.
Двухкомпонентные системы
Жидкие бинарные системы
Жидкие бинарные растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или нескольких независимых компонентов.
В растворе компоненты равноценны, при этом одно из веществ называют растворителем, а другие – растворёнными веществами.
Растворителем считается вещество, которое до образования раствора находилось в жидком агрегатном состоянии, или, в общем случае, в том же агрегатном состоянии, что и раствор.
По своей природе растворы подразделяют на:
а) идеальные;
б) бесконечно разбавленные (предельно разбавленные);
в) реальные.
Идеальный раствор – это раствор, образование которого при любом соотношении компонентов, не сопровождается тепловым эффектом (ΔНраств =0), а также расширением или сжатием системы (объём раствора обладает свойством аддитивности):
Vр-ра = V1 + V2,
где V1 и V2 – соответственно объёмы первого и второго компонентов до образования раствора.
Ни в одном реально существующем растворе эти условия не выполняются.
Раствор считается бесконечно разбавленным, если концентрация растворённого вещества в нём бесконечно мала. В таком растворе взаимодействие между молекулами растворённого вещества отсутствует, так как они разделены бесконечно большим объёмом растворителя.
В практике бесконечно разбавленные растворы не встречаются, но к ним близки по свойствам растворы газов в жидкости, с которой они химически не взаимодействуют. В водных растворах это, например, N2 и Н2, но не СО2, который вступает в реакцию
СО2 + Н2О = Н2СО3.
На практике приходится иметь дело только с реальными растворами.
Концентрации растворов
Способность вещества переходить в раствор называется растворимостью. Растворимость может быть неограниченной или ограниченной. Неограниченная растворимость присутствует только в таких системах, в которых и растворитель и растворённое вещество находятся в одинаковых фазах. Если растворитель и растворённое вещество находятся в разных по природе фазах, то растворимость ограничена некоторым пределом. При достижении предела растворимости между растворяемым веществом и образовавшимся раствором наступает равновесие.
Раствор, находящийся в данных условиях в равновесии с растворяемым веществом, называется насыщенным раствором.
Раствор, в котором при данных условиях предел растворимости не достигнут, называется ненасыщенным.
Одной из важнейших характеристик раствора является относительное содержание в нём растворённого вещества и растворителя, которое называется концентрацией. В общем случае концентрация обозначают буквой С. Качественно растворы делят на разбавленные, в которых растворённого вещества мало, и концентрированные, в котором растворённого вещества много.
В химии и смежных областях наиболее распространены следующие способы выражения концентрации:
Процентная концентрация (вес.%) выражается числом граммов растворённого вещества в 100 г раствора.
Молярная концентрация (молярность) выражается числом молей растворённого вещества в 1 л раствора.
Нормальная концентрация (нормальность) выражается числом грамм-эквивалентов растворённого вещества в 1 л раствора.
Моляльная концентрация (моляльность) выражается числом молей растворённого вещества, содержащегося в 1000 г растворителя.
Молярная доля показывает, какую часть от общего числа молей раствора составляет растворённое вещество или растворитель. Если обозначим число молей растворителя через na, а число молей растворённого вещества через nb, то молярную долю растворённого вещества можно выразить
Nв = 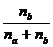 , (69)
, (69)
а мольную долю растворителя
NА = 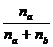 . (70)
. (70)
Сумма NА + Nв = 1.
