Опыт 1. Получение и исследование комплексного соединения сульфата тетраамминомеди (II)
Поместить в две пробирки по 10 капель 1 н. раствора сульфата меди и добавить, в одну из них 2 капли хлорида бария. На присутствие какого иона указывает выпавший осадок? Во вторую пробирку внести кусочек гранулированного олова и наблюдать выделение на его поверхности красноватого налета меди.
Получить комплексное соединение меди, для чего поместить в пробирку 10—15 капель раствора сульфата меди и по каплям добавлять гидроксид аммония NH4OH. Наблюдать растворение выпавшего вначале осадка основного сульфата меди [CuOH]2SO4 и изменение цвета раствора при образовании комплексного сульфата тетра-амминомеди (II) [Cu(NH3)4]SO4. Полученный раствор разделить в две пробирки и провести те же два опыта, которые были проделаны с раствором медного купороса. Выпадает ли осадок при добавлении хлорида бария? Выделяется ли медь на грануле олова?
Написать уравнения всех проведенных реакций. Есть ли различие в поведении сульфата меди и комплексной соли по отношению к каждому добавленному реактиву? Написать уравнение электролитической диссоциации сульфата тетраамминомеди (II).
Опыт 2.Анионные и катионные комплексы.
А. Гидроксокомплексы
В три пробирки поместить раздельно растворы солей цинка, хрома(Ш) и алюминия. В каждую из них добавлять по каплям раствор щелочи. Наблюдать вначале выпадение осадков, а затем их растворение в избытке щелочи. Написать уравнение реакции образования растворимых гидроксокомплексов, содержащих ионы [Zn(OH)4]2-, [Сr(OH)6]3-, [Аl(OH)6]3-.
Б. Комплексное основание никеля
Получить осадок гидроксида никеля (II), внеся_в пробирку 3—4 капли раствора сульфата никеля и такой же объем раствора едкого натра. Полоской фильтровальной бумаги удалить жидкую фазу.
К осадку добавить 5—6 капель конц. раствора гидроксида аммония. Что происходит? Сравнить окраску ионов Ni2+ в растворе сульфата никеляс окраской полученного раствора.
Присутствием каких ионов обусловлена окраска раствора?
Написать уравнения реакций: образования гидроксида никеля (II), взаимодействия гидроксида никеля с аммиаком и уравнение электролитической диссоциации образовавшегося комплексного основания (координационное число никеля принять равным шести). Какое основание является более сильным: простое или комплексное? Ответ обосновать.
Опыт 3.Комплексные соединения в реакциях обмена
А. В пробирку к 4—5 каплям раствора сульфата меди добавить такой же объем раствора комплексной соли K4lFe(CN)6]. Отметить цвет образовавшегося осадка гексацианоферрата меди. Написать молекулярное и ионное уравнения реакции.
Б. Получить раствор тетрамминомеди(II) (см. опыт 1), прибавить к полученному раствору 3-5 капель Na2S. Написать уравнение реакции и объяснить выпадение черного осадка, учитывая, что ПРCuS= 8,5×10-45 .
Контрольные вопросы и упражнения
1. Определить степень окисления и координационное число комплек-сообразователя в следующих соединениях:
K2[PtCl4],[Со(NН3)3С13],[Ti(H2O)4Br2]Br,K2 [Pt(C2O4)Cl2].
2. Представить координационные формулы следующих соединений:
КС1 • АuСl3, 2NH4C1 • PtCl4, Na2C2O4 • СuС2O4, PtCl2 • 4NН3.
3. По .Кнест оценить устойчивость комплексных ионов:
[Mg(NH3)6]2+,[Cu(NH3)4]2+, [Ag(NH3)2]+, [Co(NH3)6]2+.
Тепловые эффекты химических процессов
Лабораторная работа
Цель работы:
Определение с помощью простейшего калориметра теплоты реакции нейтрализации сильного основания сильной кислотой и теплоты растворения солей.
Описание исследуемых процессов
Согласно теории электролитической диссоциации, реакция между растворами сильной кислоты и сильного основания, например,
HCl(p) + NaOH(р) ® NaCl(р) +H2O ,
независимо от того, какие кислоты или основания были взяты, может быть представлена в виде
Н++ ОН- ®Н2О + 56.9 кДж.
Таким образом, в основе этих реакций лежит одно и то же термохимическое уравнение.
Растворение кристаллических солей представляет сложное физико-химическое явление. При растворении кристаллической соли протекают два основных процесса : первый - эндотермический, связанный с разрушением кристаллической решетки; второй - экзотермический, обусловленный взаимодействием растворенного вещества с молекулами растворителя с образованием гидратированных ионов. В зависимости от того, какой из двух тепловых процессов преобладает, тепловой эффект растворения может быть положительной или отрицательной величиной.
Расчет теплоты из экспериментальных данных
Расчет теплоты, поглощающейся или выделяющейся в калориметре, в данной работе проводим исходя из следующих допущений:
1) считаем, что тепловой эффект проявляется только в изменении температуры раствора и стекла конической колбы - реактора;
2) пренебрегаем относительно небольшими потерями тепла в окружающую среду;
3) принимаем теплоемкость раствора равной теплоемкости воды.
С учетом сделанных допущений выделяющуюся или поглощаемую в калориметре теплоту вычисляем по формуле
q = (cР ×mР + cС × mС) × DT,
где сР = 4.184 кДж/(кг×К); сС=0.75 кДж/(кг×К) - удельные теплоемкости раствора и стекла; mР и mС - массы раствора и стеклянной колбы-реактора; DТ - изменение температуры калориметра в ходе процесса.
Таким образом, задача калориметрического эксперимента сводится к точному определению изменения температуры калориметра DT, обусловленному тепловым эффектом.
Оборудование и реактивы
Калориметр, термометр с точностью не хуже 0.1о С. весы с точностью измерения 0.01 г. Мерный цилиндр на 100 мл. Ареометр.
Реактивы: 1М НС1; 1М НNO3 ; 3М NaOH; CuSO4 (безводный); CaSO4×5H2O (кристаллогидрат).
Опыт 1. Определение теплового эффекта реакции нейтрализации сильного основания сильной кислотой.
В сухую коническую колбу с известной массой с помощью мерного цилиндра залейте 150 мл 1М раствора соляной кислоты и поместите ее в стакан, внутри которого размещены теплоизолирующие прокладки из пенопласта. Закройте калориметр крышкой с отверстием для термометра.
Налейте в мерный цилиндр 50 мл 3М раствора NaOH и измерьте его температуру. Необходимо, чтобы температуры исходных растворов были одинаковы.
Каждый калориметрический опыт начинают с определения температурного хода калориметрической системы. Для этого в течение нескольких минут измеряют температуру калориметра. Показание термометра фиксируют через каждую минуту. Если в течение 5 минут изменения температуры невелики и равномерны (эти изменения составляют начальный период опыта), то в определенный момент отсчета вылейте в калориметр через воронку приготовленный раствор щелочи. Перемешайте растворы. С момента сливания растворов начинается главный период опыта. За счет теплового эффекта протекающей химической реакции происходит резкое изменение температуры. По окончании реакции нейтрализации температурный ход в калориметре станет снова равномерным. Момент наступления равномерного хода в калориметре является концом главного и началом конечного периода.
В конечном периоде в течение 5 минут температурные отсчеты проводятся через минуту, как и в начальном периоде.
Результаты температурных измерений изображаются в виде графика на миллиметровой бумаге. На рисунке проводится график изменения температуры в реакции нейтрализации. Здесь линии АВ, ВС и СD соответствует начальному, главному и конечному периодам реакции. Наличие температурного хода линии СD свидетельствует об имеющем место теплообмене калориметра с окружающей средой. В расчетах максимальной температуры раствора теплообмен учитывается следующим образом. Прямая АВ экстраполируется вправо, а прямая СD - влево. Интервал времени ВС делится пополам и из точки М1 проводится перпендикуляр к оси абсцисс. Отрезок HCT соответствует изменению температуры калориметра DТ, вызванному протеканием химического процесса с поправкой на теплообмен.
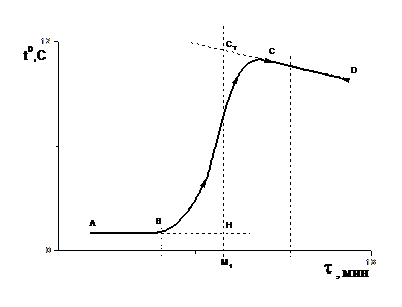
Для расчетов потребуется также значение массы раствора, находящегося в калориметре, которую можно определить либо путем взвешивания, либо из выражения mР = V×r, где V = 200 мл, а значение r можно измерить с помощью ареометра или принять равным 1 г/мл.
По указанию преподавателя процедуру определения DТ можно упростить.
1.Измерьте температуру раствора кислоты в колбе - ТК .
2.Измерте температуру раствора щелочи в цилиндре - ТЩ.
3.Начальную температуру раствора после смешения рассчитайте по формуле
Т1 = (ТК ×150 + ТЩ × 50) / 200.
4.Залейте раствор щелочи в колбу-калориметр. Сразу же после смешения закройте колбу крышкой с термометром. Энергично взбалтывая полученный раствор следите за его температурой. Отметьте максимальную температуру Т2.
5.Рассчитайте DТ = Т2 - Т1.
Результаты выполненных измерений запишите в таблицу.
| № опыта | Масса колбы-калоримет-ра, mС, г | Масса раствора в колбе, mР, г | Начальная температура раствора | Изменение температуры калориметра DТ | Использованная кислота | |
| кис-лота | NaOH | |||||
Тот же эксперимент проделайте с 1М раствором HNO3.
На основании полученных данных определить
1) количество теплоты [кДж], выделившееся при протекании реакции нейтрализации;
2) число молей образовавшейся в ходе реакции воды (рассчитать из значений концентрации щелочи или кислоты и уравнения химической реакции);
3) рассчитать тепловой эффект реакции нейтрализации (кДж/моль Н2О) и составить термохимическое уравнение изучаемой реакции;
4) сравнить значения тепловых эффектов нейтрализации 1М раствора НС1 и 1М раствора HNO3; cделать вывод.
Опыт 2. Определение тепловых эффектов растворения солей
Опыт проводится в той же калориметрической установке и по той же методике, которая описана в опыте 1.В колбу налейте 200 мл дистиллированной воды и снимите начальный температурный ход калориметра. Взвесьте ~ 5 г безводной соли с точностью до 0.01 г. Быстро внесите навеску в колбу. При постоянном взбалтывании раствора следите за показаниями термометра. Температурные измерения представьте графически и рассчитайте значения DТ.
Результаты опыта запишите в таблицу.
| № опыта | Масса колбы m1, г | Масса соли | Масса воды | Масса раствора | Изменения температуры Т1 | DТ |
Опыт повторите с кристаллогидратом соли, взяв навеску ~ 8 г. Результаты опыта запишите в таблицу.
По данным проведенного эксперимента
1) рассчитать теплоту растворения безводной соли, кДж/моль;
2) рассчитать теплоту растворения кристаллогидрата, кДж/моль;
3) используя закон Гесса по найденным теплотам растворения безводной соли и ее кристаллогидрата рассчитать теплоту гидратации безводной соли и составить термохимические уравнения этой реакции
CuSO4(кр.) + 5H2O(ж.) = CuSO4× 5H2O(кр.) + Q1 .(1)
При этом следует иметь в виду, что процесс растворения безводного сульфата меди может быть представлен в виде двух последовательно протекающих процессов : процесса (1) и
CuSO4 × 5H2O(кр.) = CuSO4(p) + 5H2O + Q2(2) или в виде одного суммарного уравнения
CuSO4(кр.) = CuSO4(p) + Q3 ,
где Q2 и Q3 - теплоты растворения кристаллогидрата и безводной соли. Учитывая, что начальное и конечное состояния в обоих случаях одинаковы, на основании закона Гесса, Q3 = Q1 + Q2, откуда Q1 = Q3 - Q2.
Контрольные вопросы
1.Рассчитайте стандартную теплоту образования диоксида азота NO2(г), если стандартный тепловой эффект реакции 2 NO2(г) « N2O4 (г) при 298К равен - 58,4 кДж/моль, а стандартная теплота образования N2O4(г) равна 9,4 кДж/моль.
2. Установите возможность (или невозможность) самопроизвольного протекания реакции СО(г) + 1/2 О2=СО2(г) при 298 К и 1 атм. Ответ подтвердите расчетом.
3. Теплоты образования воды и водяного пара равны соответственно 285,8 и 241,8 кДж/моль. Рассчитайте теплоту испарения воды при 25оС.
Жесткость воды
Введение
Абсолютно чистой воды в природе не бывает. При взаимодействии воды с атмосферой и почвой в ней растворяются органические и неорганические соединения. Особое значение имеют присутствующие в воде многозарядные катионы Ca2+ и Mg2+. Если концентрация этих ионов велика, то воду называют жесткой, если мала - мягкой. Жесткость воды подразделяют на карбонатную и некарбонатную.
Карбонатной называют жесткость, обусловленную присутствием в воде гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. При повышении температуры, особенно при кипячении, эти соли разлагаются с образованием малорастворимых карбоната кальция и гидроксида магния и жесткость устраняется :
to
Ca(HCO3)2 ® CaCO3¯+H2O+CO2,
to
 Mg(HCO3) ® Mg(OH)2¯ +2CO2.
Mg(HCO3) ® Mg(OH)2¯ +2CO2.
Поэтому карбонатную жесткость еще называют временной.
Некарбонатная жесткость определяется содержанием в воде сульфатов и хлоридов кальция и магния. При кипячении эти соли не удаляются из воды. Поэтому некарбонатную жесткость еще называют постоянной. Сумма постоянной и временной жесткости дает общую жесткость воды.
Жесткость характеризуют числом моль эквивалентов солей Са2+ и Mg2+ в 1л воды. Жкарб. - карбонатная жесткость воды, определяется количеством ммоль эквивалентов анионов НСО3- в 1л воды: Жкарб.= СN(НСО3)×103, мэкв/л. Жобщ. - общая жесткость воды, определяется количеством ммоль эквивалентов катионов Ca2+, Mg2+ в 1л воды: Жобщ.= [СN(Са2+)+СN(Mg2+) ]× 103, мэкв/л.
Жнекарб.=Жобщ. - Жкарб.
Жесткая вода непригодна в качестве теплоносителя на энергообъектах, ее вкусовые качества невелики, стирка в жесткой воде возможна только при повышенном расходе моющих средств. Поэтому воду умягчают, т.е. снижают содержание ионов Ca2+ и Mg2+.
Один из простейших способов устранения жесткости - кипячение (см. выше уравнения протекающих при этом реакций). В этом случае из воды удаляются лишь гидрокарбонаты. Химические способы устранения жесткости – известкование (добавление в воду гашеной извести Ca(OH)2) и содирование (добавление кальцинированной соды Na2CO3). Современными методами умягчения воды являются дистилляция (испарение воды с образованием концентрированных растворов солей), обратный осмос (молекулярное фильтрование) и ионный обмен (сорбция ионов Са2+ и Mg2+ полимерными смолами, сопровождающаяся поступлением в воду эквивалентных количеств других катионов, например, H+)
Определение карбонатной жесткости основано на реакции
HCO3- + H+ ® H2O + CO2 (Н2СО3).
Образующийся углекислый газ остается в растворе в виде Н2СО3, т.к. его количество невелико. Раствору СО2 в воде соответствует рН » 4, поэтому точку эквивалентности определяют по изменению окраски метилового оранжевого, которая при рН = 4 переходит из желтой в оранжевую.
Общую жесткость воды можно определить с помощью раствора двухзамещенной натриевой соли этилендиаминтетерауксусной кислоты (комплексон III, Na2ЭДТА или трилон – В):
 HO OH
HO OH
:O=C-CH2 CH2-C=O:
N-CH2-CH2-N
:O=C-CH2 CH2-C=O:
NaO Ona
(Na2H2ЭДТА)
Это вещество за счет электронных пар, обозначенных точками, образует донорно–акцепторные связи с комплексообразователями, в качестве которых выступают ионы Са2+ и Mg2+. При образовании комплекса происходит замена двух ионов водорода соли на 1 ион металла:
Са2+ + Н2ЭДТА2- ®[Са(ЭДТА)]2- + 2Н+
Mg2++ Н2ЭДТА2- ®[ Mg(ЭДТА)]2- + 2Н+
Образующиеся комплексы очень устойчивы (КН » 1×10-11 для первого, КН » 1×10-9 для второго), т.к. число донорно–акцепторных связей 1 иона металла с 1 молекулой–лигандом (дентантность) равно 6. При титровании трилон–В реагирует с ионами металлов до тех пор, пока все ионы Са2+ и Mg2+ не окажутся связанными.
Индикатором точки эквивалентности служат соединения, дающие с ионами Са2+ или Mg2+ окрашенные комплексы, менее прочные, чем комплексы с Na2H2ЭДТА. Таким индикатором является эриохром черный (ЭТ - 00). Это органический краситель, дающий с Mg2+ комплексную соль красно-фиолетового цвета.
Таким образом, если к жесткой воде прибавить несколько капель спиртового раствора ЭТ-00, то вода окрасистся в красно-фиолетовый цвет вседствие присутствия в ней ионов магния. Если же затем понемногу прибавлять раствор комплексона III с известной концентрацией, в первую очередь будет образовываться наиболее прочный комплекс с ионами кальция, а затем менее прочный комплекс с ионами магния. При этом комплекс ионов магния с индикатором, как наименее прочный, распадется и цвет воды перейдет из красно-фиолетового в синий (точка эквивалентности)
Следует иметь в виду, что эриохром черный имеет синий цвет только при pH=7-11, а в кислой среде он принимает вишнево-красный цвет. Поэтому титрование ведут в присутствии буферного раствора NH4ОН - NH4Cl, для которого pH = 9 - 10. Буфер нейтрализует кислоту, выделяющуюся при титровании.
Лабораторная работа
Цель работы: определение жесткости водопроводной воды.
Приборы и посуда
1. Колбы конические 150 мл - 3 шт., 250 мл - 1 шт.
2. Бюретки 50 мл - 2 шт.
3. Мерный стаканчик на 10 мл - 1 шт.
4. Мерный цилиндр на 50 - 100 мл.
Реактивы
1. 0.01 N НС1
2. 0.02 N Na2H2ЭДТА.
3. Буферная смесь NH3 + NH4Cl.
4. Раствор метилового оранжевого.
5. Раствор ЭТ - 00.
Выполнение работы
По указанию преподавателя работа проводится с горячей или холодной водопроводной водой. Для проведения экспериментов необходимо не менее 300 мл воды. Ее нужно отобрать сразу, т.к. жесткость водопроводной воды со временем может меняться. Отберите воду в колбу на 250 мл и в мерный цилиндр.
