Теория электролитической диссоциации. Изотонический коэффициент, степень диссоциации, константа диссоциации электролита.
Физический смысл изотонического коэффициента был выяснен шведским ученым Сванте Аррениусом. Он выдвинул в 1887 г. теорию электролитической диссоциации.
Ее основные положения:
1. При растворении в воде молекулы электролитов диссоциируют на положительно и отрицательно заряженные ионы.
2. Положительно заряженные ионы (катионы) представляют собой главным образом ионы водорода и ионы металлов. Все остальные ионы (анионы) заряжены отрицательно.
3. Количественно процесс диссоциации характеризуется степенью диссоциации α, выраженной в долях единицы или процентах:
α = Nпрод./N
N – число внесенных в раствор молекул;
N прод. – число продиссоциировавших молекул.
По величине степени диссоциации электролиты делятся на сильные, степень диссоциации которых находится в интервале от 0,3 до 1, средней силы со степенью диссоциации от 0,03 до 0,3 и слабые со степенью диссоциации менее 0,03.
К сильным электролитам относятся некоторые минеральные кислоты (серная, азотная, соляная), щелочи (едкий натр и едкое кали), большинство солей, к слабым некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований (гидроксид меди (II), гидроксид железа (III)), практически все органические кислоты (уксусная к-та).
Поскольку благодаря диссоциации молекул веществ на ионы реальные концентрации частиц в растворе оказываются большими, чем рассчитанные без учета диссоциации и приходится вводить изотонический коэффициент.
Так, в водном растворе уксусная кислота диссоциирует, поэтому концентрация частиц становится больше исходной концентрации молекул:
CH3COOH ↔ CH3COO- + H+
Изотонический коэффициент при этом i › 1.
Но возможен процесс и ассоциации: для бензольного раствора уксусной кислоты i < 1, так как в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением (димеризация)
2 CH3COOH ↔ (CH3COOH)2
константа диссоциации (Кдисс.):
KatnAnm ↔ nKat+ + mAn-
где Kat – катион (положительно заряженный ион металла),
An – анион (отрицательно заряженный ион кислотного остатка).
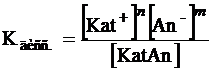
25. Вода как растворитель. Использование воды в технологических процессах. Процесс водоподготовки.
Вследствие уникальной способности воды растворять различные вещества, в природе чистой воды, т.е. без примесей, не существует. В одном литре пресной воды, употребляемой нами, содержится до 1 г разных веществ. Эти вещества необходимы для обеспечения нашей жизнедеятельности, а так же жизнедеятельности растений и животных. Дистиллированная вода для них так же вредная, как и слишком минерализованная.
Из-за способности воды растворять многие химические вещества, при нынешней экологической обстановке, она стала объектом постоянного и интенсивного загрязнения
Умягчение воды – это процесс удаления солей жесткости – ионов кальция и магния, который важен в водоподготовке для таких отраслей, как пищевая, энергетическая и других. Для выполнения этой операции требуется специальная станция умягчения воды.
Обратный осмос — процесс, в котором с помощью давления принуждают растворитель (обычно вода) проходить через полупроницаемую мембрану из более концентрированного в менее концентрированный раствор, то есть в обратном для осмоса направлении
Ионное произведение воды, водородный показатель. Регулирование водородного показателя в технологических процессах.
Ио́нное произведе́ние воды́ — произведение концентрацийионовводорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Водородный показатель рН — показатель степени щелочности или кислотности воды. При рН = 7 вода имеет нейтральную реакцию, при рН > 7 — щелочную, а при рН < 7 — кислую.
При повышенном уровне рН происходит выпадение известкового осадка, вода приобретает неприятный запах, способна вызывать раздражение глаз и кожи у купающихся. Если значение рН понижено, металлическим деталям бассейна угрожает коррозия, а материалам и швам плиточного покрытия — разрушение.
