Концентрация растворов. Способы выражения состава растворов.
Способы выражения концентрации растворов:
1. Молярная концентрация – это химическое количество вещества, содержащееся в одном литре раствора: СМ = 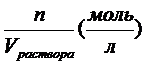 . Молярная концентрация — показывает, сколько моль вещества содержится в 1 л раствора. Например, CМ(KMnО4) = 0,02 моль/л или 0,02 М КМnО4.
. Молярная концентрация — показывает, сколько моль вещества содержится в 1 л раствора. Например, CМ(KMnО4) = 0,02 моль/л или 0,02 М КМnО4.
2. Молярная концентрация эквивалента (нормальная концентрация) - это химическое количество вещества эквивалентов, содержащееся в одном литре раствора Cэкв. = 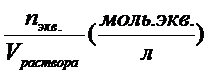 . Нормальная концентрация показывает, сколько моль эквивалентов вещества содержится в 1л раствора. Например, Сэкв.( 1/2 Н2SO4) = 0,10 моль экв./л или
. Нормальная концентрация показывает, сколько моль эквивалентов вещества содержится в 1л раствора. Например, Сэкв.( 1/2 Н2SO4) = 0,10 моль экв./л или
0,1 н, Сэкв. (1/5 КМnО4) = 0,05 моль экв./л или 0,05 н.
3. Массовая доля - это отношение массы вещества к массе раствора: w(X) = m (X)/m(раствора). Величина безразмерная или в процентах иногда выражается. При выражении в процентах необходимо массовую долю умножить на 100%.
4. Моляльная концентрация – это химическое количество вещества, растворенное в одном килограмме растворителя: Cm = 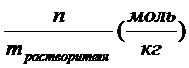 .
.
5. Титр раствора – это количество вещества в граммах, содержащееся в одном миллилитре раствора: Т = 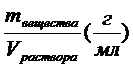 .
.
6. Молярная доля вещества – доля химического количества вещества в суммарном химическом количестве всех (m) веществ смеси (раствора). Численно равна отношению химического количества вещества в смеси (растворе) к суммарному числу молей всех компонентов смеси (раствора) 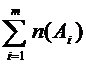 : χ (Аi) =
: χ (Аi) = 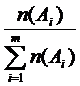 или в процентах: χ (Аi) =
или в процентах: χ (Аi) = 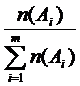 . 100%.
. 100%.
Очевидно, что сумма молярных долей всех компонентов смеси (раствора) равна единице:
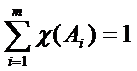 или в процентах:
или в процентах: 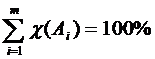 .
.
Связь различных способов выражения концентрации растворов:
1) Молярность - массовая доля (СМ - ω).
Молярная концентрация – это химическое количество вещества, содержащееся в одном литре раствора: СМ = 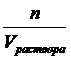 . Пусть Vраствора = 1л, тогда СМ = n =
. Пусть Vраствора = 1л, тогда СМ = n = 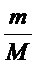 , масса вещества, выраженная через массовую долю равна: m = ω.mраствора = ω.ρ.1000, так как ω =
, масса вещества, выраженная через массовую долю равна: m = ω.mраствора = ω.ρ.1000, так как ω = 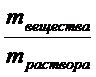 , а масса одного литра раствора равна: mраствора = ρ.1000, где ρ – плотность раствора в г/мл. Подставляем полученное выражение для массы вещества и получаем: СМ = ω. ρ.1000/M =
, а масса одного литра раствора равна: mраствора = ρ.1000, где ρ – плотность раствора в г/мл. Подставляем полученное выражение для массы вещества и получаем: СМ = ω. ρ.1000/M = 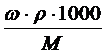 .
. 
2) Моляльность – массовая доля (Cm - ω).
Моляльная концентрация – это химическое количество вещества, растворенное в одном килограмме растворителя: Cm = 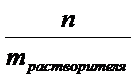 =
= 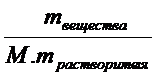 , разделим числитель и знаменатель на массу раствора, тогда Cm =
, разделим числитель и знаменатель на массу раствора, тогда Cm = 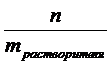 =
= 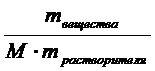 =
= 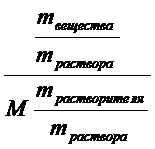 . Очевидно что mвещества /mраствора = ω,
. Очевидно что mвещества /mраствора = ω,
mрастворителя/ mраствора = 1 – ω, так как mрастворителя = mраствора - mвещества , тогда с учетом того, что молярная масса М определяется в граммах, а моляльная концентрация на килограмм растворителя получаем, умножив на 1000: Cm = ω.1000/M(1 – ω) = 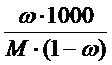 .
.
3) Молярность – нормальность (СМ – Сэкв.).
Так как Cэк. = 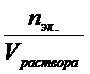 , СМ =
, СМ = 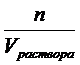 , nэк. = z . n или n = nэкв.. fэкв. , где fэкв. – фактор эквивалентности, z – число эквивалентности растворенного вещества (fэкв. = 1/z), nэкв. = z . n = z . СМ . Vраствора. Подставляя в первое уравнение полученное из второго уравнения выражение для количества молей-эквивалентов и, сокращая в числителе и знаменателе Vраствора, получаем: Cэк. = Z.CM
, nэк. = z . n или n = nэкв.. fэкв. , где fэкв. – фактор эквивалентности, z – число эквивалентности растворенного вещества (fэкв. = 1/z), nэкв. = z . n = z . СМ . Vраствора. Подставляя в первое уравнение полученное из второго уравнения выражение для количества молей-эквивалентов и, сокращая в числителе и знаменателе Vраствора, получаем: Cэк. = Z.CM
В итоге связь различных способов выражения концентраций выглядит следующим образом: СМ = ω. ρ.1000/M = 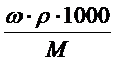 ; Cm = ω.1000/M(1 – ω) =
; Cm = ω.1000/M(1 – ω) = 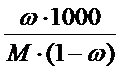 ;
;
CM = fэк..Сэк. ; Z.CM = Cэк., где
СМ = 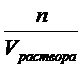 –молярная концентрация (моль/л), Cm =
–молярная концентрация (моль/л), Cm = 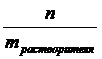 – моляльная концентрация (моль/кг), Cэк. =
– моляльная концентрация (моль/кг), Cэк. = 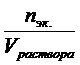 – молярная концентрация эквивалентов (моль.эк./л) (нормальность раствора).
– молярная концентрация эквивалентов (моль.эк./л) (нормальность раствора).
Электролиты и неэлектролиты. Свойства растворов неэлектролитов. Диффузия и осмос. Осмотическое давление (закон Вант-Гоффа). Давление пара раствора, зависимость от молярной доли. Температура кипения и замерзания раствора. Законы Рауля.
Электролиты – вещества, растворы или расплавы которых проводят электрический ток: соли, ксилоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролиты – вещества, растворы и расплавы которых не проводят электрический ток: кислород, водород, многие органические вещества. В молекулах этих веществ существуют ковалентные неполярные или малоплдярные связи.
Электролитическая диссоциация – процесс распада вещества при его растворении на ионы.
Неподчинение свойств растворов некоторых классов веществ законам Рауля и Вант-Гоффа: Законы Рауля и Вант-Гоффа справедливы для разбавленных водных растворов определенных классов растворенных веществ (особенно органических: спиртов, альдегидов, кислот, сахара и др.). Но, оказывается, свойства растворов не всех веществ подчиняются законам Рауля и Вант-Гоффа. Анализируя экспериментальные данные осмотического давления для растворов неорганических солей, кислот и щелочей, Вант-Гофф обнаружил, что результаты не совпадают с рассчитанными по уравнению Рос. = СмRT.
Экспериментальные значения осмотического давления для растворов этих классов веществ оказались явно большими, чем рассчитанные по уравнению. Подобные же отклонения измеренных величин от вычисленных по соответствующим уравнениям законов Рауля наблюдались и для температур начала кипения, кристаллизации и давления насыщенного пара: температура начала кипения раствора оказалась много выше, температура начала замерзания ─ много ниже, давление насыщенного пара растворителя – много меньше.
Воспользоваться уравнениями Вант-Гоффа и Рауля можно было бы, если ввести в них поправочный коэффициент. Вант-Гофф ввел в уравнение для осмотического давления раствора поправочный коэффициент «i», назвав его изотоническим коэффициентом (коэффициент равного давления). И выражение для осмотического давления для растворов, не подчиняющихся закону Вант-Гоффа, тогда запишется в таком виде: Рос. = iCмRT.
Физический смысл изотонического коэффициента пока не ясен. Это просто поправочный коэффициент. Численно его определяют для растворов разных веществ (например, поваренной соли NaCl, серной кислоты H2SO4, гидро-
ксида натрия NaOH и т.п.) и их различных концентраций. Для растворов солей, кислот, щелочей он больше единицы и при разбавлении растворов приближается к целочисленным значениям натурального ряда: 1, 2, 3, 4, 5 … . Для хлорида
калия КС,l например, он растет и приближается к значению 2, а для хлорида бария BaCl2 – к 3.
Подстановка изотонического коэффициента «i» и в уравнения Рауля: ∆tкип. = i ЭСm и ∆tзам. = i Кзам.Сm,
позволяет использовать и их для расчетов свойств разбавленных растворов всех веществ.
Формально, исходя из этих уравнений, изотонический коэффициент показывает, во сколько раз экспериментальное (опытное) значение того или иного свойства раствора отличается от теоретически рассчитанного по законам Рауля
и Вант-Гоффа:
i=Росм.опытное/ Росм.теор.= ∆t кип. опытное/∆t кип.теор= ∆t зам. Опытное/∆t зам.теор. или i=рос.опытное/ См RT=∆t кип.опытное/ ЭСm=∆t крис.опытное/ К зам.Сm.
Во все эти выражения, не считая постоянных величин: эбулиоскопической ─ Э, криоскопической ─ Кзам. констант, газовой постоянной ─ R и температуры –Т, входит концентрация растворенного вещества, т.е. количество час-
тиц растворенного вещества остается неизменным при растворении. Свойства же растворов при растворении этих веществ отличаются от теоретически рассчитанных.
На примере проведем расчет значения изотонического коэффициента из экспериментальных данных.
Электролитическая диссоциация ( ионизация). Факторы, определяющие склонность веществ к диссоциации. Механизм диссоциации веществ с различным характером химической связи . Гидратация ионов в растворе, ион гидроксония.
Электролитическая диссоциация (ионизация) – это процесс распада молекул электролитов на ионы в растворе или в расплаве.
Теория электролитической диссоциации:
1. молекулы электролитов при растворении или расплавлении распадаются на ионы (атомы или группы атомов, имеющий положительный или отрицательный заряд).
2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отриуательно заряженые ионы движутся к положительно заряженному электроду (аниоду).
3. Диссоциация – процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы(ионизация или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Общая сумма зарядов катиона равна общей сумме зарядов аниона и противоположна по знаку.
Изотонический коэффициент – он показывает – во сколько раз увеличилось количество частиц в растворе по сравнению с растворенным количеством: i=фактическое количество частиц растворенного вещества в единице объема/число растворяемых частиц ( молекул) в единице объема.
Вещества, растворы и расплавы которых обладают ионной проводимостью называют электролитами. Необходимым условием, определяющим возможность процесса электролитической диссоциации, является наличие в растворяемом веществе ионных * или полярных связей *, а также достаточная полярность * самого растворителя *. Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации α и константой диссоциации K.
Механизм диссоциации веществ с различным характером химической связи.
Механизм диссоциации электролитов с ионной связью – при растворении в воле ионных соединений, например хлорида натрия, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам, отрицательные полюсы – к положительным ионам натрия. В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т.е. являются гидратированными ионами. Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи.
Механизм диссоциации электролитов, которые состоят из полярных молекул - при растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие его молекул с молекулами воды. Под влиянием этого взаимодействия изменяется характер связи у хлороводорода: сначало связь становится более полярной, а затем переходит в ионную связь. Результатом этого процесса является диссоциация электролита и образование в растворе гидратированных ионов. Так диссоциируют кислородсодержащие и бескислородные соли. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов. Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода, соединяясь с молекулами воды образуют ионы гидроксония H3O+ по донорно-акцепторному механизму. Для простоты в химических уравнениях ионы изображают без молекул воды.
Свойства ионов: ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия и хлорид-ионы не взаимодействуют с водой, не имеют запаха, цвета, неядовиты. Атомы натрия энергично взаимодействуют с водой. Вещество хлор в свободном состоянии – газ желто-зеленого цвета, ядовит, сидбный окислитель. Различные свойства ионов и атомомв одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных сосояниях, чем атомы. Ионы имеют различную окраску. Гидратированные и негидратированные ионы s- и p-элементов обычно бесцветны (H+, Na+, K+, Ba2+, Al3+). Ионы некоторых d-элементов имеют окраску. Окраска гидратированных и негидратированных ионов одного и того же элемента может быть различной. Например, негидратированные ионы Cu2+ - бесцветные, а гидратированные ионы меди Cu2+*4H2O – синего цвета.
