Способы выражения состава растворов
Состав раствора выражают с помощью так называемых дольных величин, или с помощью концентрации.
Концентрацией[35] раствора называется содержание растворённого вещества в определённой массе или определённом объёме раствора или растворителя.
Способы выражения концентрации не учитывают, что происходит с данным веществом при растворении.
Молярная (мольно-объёмная) концентрация (молярность) называется число молей растворённого вещества В (сВ), содержащегося в 1 л раствора определяется как отношение количества этого вещества (nВ, моль[36]) к объёму раствора (V, л):
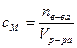 [моль/л].
[моль/л].
Допускается обозначать молярную концентрациюбуквой М, например: 1 М – одномолярный раствор (1 моль в литре); 2 М – двумолярный раствор (2 моль в литре); 0,1 М – децимолярный раствор (0,1 моль в литре); 0,01 М – сантимолярный раствор; 0,001 М, или 10-3 моль/л – миллимолярный раствор.
Молярная концентрация химического эквивалента (или эквивалентная концентрация, или нормальность; Н)называется число молейэквивалентов растворённого вещества В [nэкв(В), сэкв(B)], содержащихся в 1 л раствора, и определяется как отношение количества вещества его эквивалентов nэквВ (моль) к объёму раствора V (л).
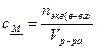 [моль*экв/л].
[моль*экв/л].
Запись 0,01 н. КМnО4 означает сантинормальный раствор КМnО4.
Из приведённых соотношений следует, что
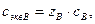
т. е. молярная концентрация эквивалентов растворённого вещества Вв конкретной химической реакции в zВ раз больше его молярной концентрации.
Нормальная (или эквивалентная) концентрация. Нормальным (1 н.) называется раствор, содержащий в одном литре один моль химических эквивалентов растворённого вещества. В общем случае молярные (нормальные) массы химических эквивалентов находят, деля молярную массу электролита на число валентных связей между образующими его молекулу ионами. Например, нормальные массы НNО3, Bа(ОН)2 и Аl2(SО4)3 соответственно равны М, М/2 и М/3, где Q = 3/2. Растворы с одинаковыми нормальными концентрациями электро-литов (например, щёлочь[37] и кислота) будут реагировать в равных объёмах.
При одинаковой нормальной концентрации растворов различные электролиты диссоциированы в разной степени. Например, хлорид натрия NаС1 построен из однозарядных ионов, а сульфат магния МgSО4 – из двухзарядных (во втором случае силы притяжения между ионами должны быть больше).
Титр, или массовая концентрация, определяется отношением массы растворенного вещества В к объему раствора:
Т = mВ/V
Титр выражают в г/мл, г/л, мг/мл, кг/м3 и т.д. Этот способ выражения концентрации растворов специфичен для аналитической химии.
Моляльную концентрациюрастворённого вещества(моляльность)(моль/кг) В (сm),определяют из отношения количества вещества В (nВ, моль) к массе растворителя (ms, кг):
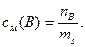 [моль/кг].
[моль/кг].
Запись 2сm (НСl) означает, что в растворе на каждый килограмм растворителя приходится 2 моль хлороводорода (двумоляльный раствор).
Молярная долярастворённого вещества(доли единицы или %) В (хВ) равна отношению количества вещества В (nВ, моль) к суммарному количеству всех веществ, образующих раствор:
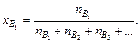
Массовая долярастворённого вещества (доли единицы или %) В (ωВ) – это отношение массы растворённого вещества mВ (г) к массе раствора m (г):
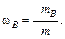
Массовая доля показывает, какую часть массы раствора составляет масса растворённого вещества. Если значение ωВ умножить на 100, то получится массовая доля, выраженная в процентах.
Концентрацию раствора иногда выражают также числом граммов растворённого вещества в определённом объёме раствора (плотность)или на определённый объём растворителя.
Концентрация насыщенного раствора численно определяет растворимость вещества при данных условиях (эти величины можно найти в справочниках). Растворимость веществ трудно предугадать, не всегда предсказуемо она изменяется при изменении температуры.
Для предсказания растворимости вещества можно руководствоваться принципом: подобное растворяется в подобном. Если молекулы растворителя неполярны или малополярны (например, бензол, эфир), он будет хорошо растворять вещества с неполярными или малополярными молекулами, хуже – вещества с большой полярностью молекул и практически не будет растворять вещества, построенные по ионному типу. Растворитель с сильно выраженным полярным характером молекул (например, вода) будет, как правило, хорошо растворять ионные вещества и вещества, образованные сильнополярными молекулами, и плохо растворять вещества, образованные неполярными или малополярными молекулами.
Полярность растворителя может быть охарактеризована величиной его диэлектрической проницаемости (ε), которая показывает, во сколько раз по сравнению с вакуумом (ε = 1) меньше притяжение или отталкивание между двумя расположенными в данной среде электрическими зарядами. Такое ослабление взаимодействия при прочих равных условиях тем больше, чем полярнее молекулы растворителя. Диэлектрические проницаемости жидкостей уменьшаются с повышением температуры.
РАСТВОРИМОСТЬ ГАЗОВ,
ЖИДКОСТЕЙ И ТВЁРДЫХ ВЕЩЕСТВ
Обычно приходится иметь дело с растворами в жидкостях, главным образом в воде.
