Влияниеконцентрацийвеществнаскоростьхимическойреакции
Чтобывеществапрореагировали, необходимо, чтобыихмолекулыстолкнулись. Вероятностьстолкновениядвухлюдейнаоживленнойулицегораздовыше, чемнапустынной. Такисмолекулами. Очевидно, чтовероятностьстолкновениямолекулнарисункеслевавыше, чемсправа. Онапрямопропорциональнаколичествумолекулреагентоввединицеобъема, т.е. молярнымконцентрациямреагентов. Этоможнопродемонстрироватьспомощью модели.
Числа n, m ввыражениизаконадействующихмассназываются порядкамиреакции посоответствующимвеществам. Этоэкспериментальноопределяемыевеличины. Суммапоказателейстепеней n, m называется общимпорядкомреакции.
Обратитевнимание, чтостепениприконцентрацияхАиВвобщемслучае неравныстехиометрическимкоэффициентам вреакции! Онистановятсячисленноравнымитольковтомслучае, еслиреакцияпротекаетименнотак, какзаписывается (такиереакцииназываются простыми или элементарными идостаточноредки). Вбольшинствеслучаевуравнениереакцииотражаетлишьсуммарныйрезультатхимическогопроцесса, анеегомеханизм.
Хотитеузнать, какэтополучается?
Коэффициентпропорциональности k называется константойскоростиреакции. Значениеконстантыскоростиреакциипостояннодляданнойреакцииприданнойтемпературе.
Влияниетемпературынаскоростьреакции
Константаскоростиреакцииестьфункцияоттемпературы; повышениетемпературы, какправило, увеличиваетконстантускорости. ПерваяпопыткаучестьвлияниетемпературыбыласделанаВант-Гоффом, сформулировавшимследующееэмпирическоеправило: Приповышениитемпературынакаждые 10 градусовконстантаскоростиэлементарнойхимическойреакцииувеличиваетсяв 2 — 4 раза. Величина, показывающая, восколькоразувеличиваетсяконстантаскоростиприповышениитемпературына 10 градусов, естьтемпературныйкоэффициентконстантыскоростиреакцииу. МатематическиправилоВант-Гоффаможнозаписатьследующимобразом: ОднакоправилоВант-Гоффаприменимолишьвузкомтемпературноминтервале, посколькутемпературныйкоэффициентскоростиреакцииусамявляетсяфункциейоттемпературы; приоченьвысокихиоченьнизкихтемпературахустановитсяравнымединице (т.е. скоростьхимическойреакцииперестаетзависетьоттемпературы)
Очевидно, чтовзаимодействиечастицосуществляетсяприихстолкновениях; однакочислостолкновениймолекулоченьвеликои, еслибыкаждоестолкновениеприводилокхимическомувзаимодействиючастиц, всереакциипротекалибыпрактическимгновенно. Аррениуспостулировал, чтостолкновениямолекулбудутэффективны (т.е. будутприводитькреакции) тольковтомслучае, еслисталкивающиесямолекулыобладаютнекоторымзапасомэнергии - энергиейактивации. Энергияактивацииестьминимальнаяэнергия, которойдолжныобладатьмолекулы, чтобыихстолкновениемоглопривестикхимическомувзаимодействию. Рассмотримпутьнекоторойэлементарнойреакции: А+В ->СПосколькухимическоевзаимодействиечастицсвязаносразрывомстарыххимическихсвязейиобразованиемновых, считается, чтовсякаяэлементарнаяреакцияпроходитчерезобразованиенекоторогонеустойчивогопромежуточногосоединения, называемогоактивированнымкомплексом
5.Ката́лиз (греч. κατάλυσις восходитк καταλύειν — разрушение) —избирательноеускорениеодногоизвозможныхтермодинамическиразрешенныхнаправленийхимическойреакцииподдействием катализатора(ов), которыймногократновступаетвпромежуточноехимическоевзаимодействиесучастникамиреакцииивосстанавливаетсвойхимическийсоставпослекаждогоциклапромежуточныххимическихвзаимодействий.[1]
Основныепринципыкатализа
Катализаторизменяетмеханизмреакциинаэнергетическиболеевыгодный, тоестьснижает энергиюактивации. Катализаторобразуетсмолекулойодногоизреагентовпромежуточноесоединение, вкоторомослабленыхимическиесвязи. Этооблегчаетегореакциюсовторымреагентом. Важноотметить, чтокатализаторыускоряютобратимыереакции, каквпрямом, такивобратномнаправлениях.
Одноизнаиболееэффективныхсредстввоздействиянаскоростьхимическихреакций - использованиекатализаторов. Катализаторы - этовещества, которыеизменяютскоростьреакции, асамикконцупроцессаостаютсянеизменнымипосоставуипомассе. Иначеговоря, вмоментсамойреакциикатализаторактивноучаствуетвхимическомпроцессе, нокконцуреакцииреагентыизменяютсвойхимическийсостав, превращаясьвпродукты, акатализаторвыделяетсявпервоначальномвиде. Обычноролькатализаторазаключаетсявувеличениискоростиреакции, хотянекоторыекатализаторынеускоряют, азамедляютпроцесс. Явлениеускоренияхимическихреакцийблагодаряприсутствиюкатализаторовноситназваниекатализа, азамедления - ингибирования.
6.Химическоеравновесие — состояние химической системы, вкотором обратимо протекаетоднаилинесколько химическихреакций, причём скорости вкаждойпарепрямая-обратнаяреакцияравнымеждусобой. Длясистемы, находящейсявхимическомравновесии, концентрации реагентов, температура идругиепараметрысистемынеизменяютсясовременем.[1]
Конста́нтаравнове́сия — величина, определяющаядляданной химическойреакции соотношениемеждутермодинамическими активностями (либо, взависимостиотусловийпротеканияреакции, парциальнымидавлениями, концентрациями или фугитивностями) исходныхвеществипродуктоввсостоянии химическогоравновесия (всоответствиис закономдействующихмасс). Знаяконстантуравновесияреакции, можнорассчитатьравновесныйсоставреагирующейсмеси, предельныйвыходпродуктов, определитьнаправлениепротеканияреакции.
7. Переводравновеснойхимическойсистемыизодногосостоянияравновесиявдругоеназываетсясмещением (сдвигом) химическогоравновесия, котороеосуществляетсяизменениемтермодинамическихпараметровсистемы температуры, концентрации, давления Присмещенииравновесиявпрямомнаправлениидостигаетсяувеличениевыходапродуктов, априсмещениивобратномнаправлении уменьшениестепенипревращенияреагента. Ито, идругоеможетоказатьсяполезнымвхимическойтехнологии.
ПринципЛеШателье —Брауна (1884 г.) —еслинасистему, находящуюсявустойчивомравновесии, воздействоватьизвне, изменяякакое-либоизусловийравновесия (температура, давление, концентрация, внешнее электромагнитноеполе), товсистемеусиливаютсяпроцессы, направленныенакомпенсациювнешнеговоздействия.
АнриЛеШателье (Франция) сформулировалэтоттермодинамическийпринципподвижногоравновесия, позжеобобщённый КарломБрауном[1].
Принципприменимкравновесиюлюбойприроды: механическому, тепловому, химическому, электрическому (эффектЛенца, явлениеПельтье)[2].
Влияниеконцентрации
Влияниеконцентрациинасостояниеравновесияподчиняетсяследующимправилам:
· Приповышенииконцентрацииодногоизисходныхвеществравновесиесдвигаетсявнаправленииобразованияпродуктовреакции;
· Приповышенииконцентрацииодногоизпродуктовреакцииравновесиесдвигаетсявнаправленииобразованияисходныхвеществ.
Влияниедавления
Давлениесущественновлияетнаположениеравновесиявреакцияхсучастиемгазообразныхвеществ, сопровождающихсяизменениемобъёмазасчётизмененияколичествавеществаприпереходеотисходныхвеществкпродуктам:
Приповышениидавленияравновесиесдвигаетсявнаправлении, вкоторомуменьшаетсясуммарноеколичествомолейгазовинаоборот.
Вреакциисинтезааммиакаколичествогазовуменьшаетсявдвое: N2 + 3H2 ↔ 2NH3
Значит, приповышениидавленияравновесиесмещаетсявсторонуобразования NH3, очёмсвидетельствуютследующиеданныедляреакциисинтезааммиакапри 400 °C:
| давление, МПа | 0,1 | |||||
| объемнаядоля NH3, % | 0,4 |
Влияниетемпературы
Влияниетемпературызависитотзнакатепловогоэффектареакции. Приповышениитемпературыхимическоеравновесиесмещаетсявнаправлении эндотермическойреакции, припонижениитемпературы —внаправлении экзотермическойреакции. Вобщемжеслучаеприизменениитемпературыхимическоеравновесиесмещаетсявсторонупроцесса, знакизмененияэнтропиивкоторомсовпадаетсознакомизменениятемпературы. ЗависимостьконстантыравновесияоттемпературывконденсированныхсистемахописываетсяуравнениемизобарыВант-Гоффа:
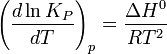
всистемахсгазовойфазой —уравнениемизохорыВант-Гоффа
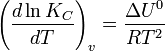
Внебольшомдиапазонетемпературвконденсированныхсистемахсвязьконстантыравновесиястемпературойвыражаетсяследующимуравнением:
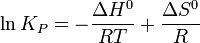
Например, вреакциисинтезааммиака
N2 + 3H2 ⇄ 2NH3 + Q
тепловойэффектв стандартных условияхсоставляет +92 кДж/моль, реакцияэкзотермическая, поэтомуповышениетемпературыприводитксмещениюравновесиявсторонуисходныхвеществиуменьшениювыходапродукта.
9.Раство́р — гомогенная (однородная) смесь, состоящаяизчастицрастворённоговещества, растворителяипродуктовихвзаимодействия. "Гомогенный" - значит, каждыйизкомпонентовраспределёнвмасседругоговвидесвоихчастиц, тоестьатомов, молекулилиионов.[1].
