Уравнения реакций, характеризующих химические свойства алкенов
Строение алканов
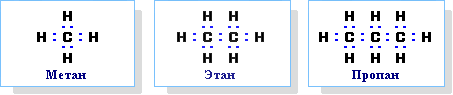
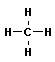
- Химическое строение простейших алканов – метана, этана и пропана – показывают их структурные формулы. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности. Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул:
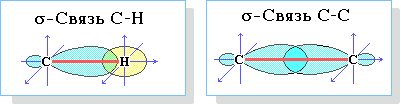
Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности. Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации. Насыщенный атом углерода в алканах связан с четырьмя другими атомами, его состояние соответствует sp3-гибридизации: каждая из четырех sp3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя σ-связи С-Н или С-С.
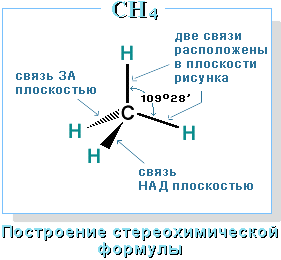
Четыре σ-связи углерода направлены в пространстве под углом 109о28', что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода: 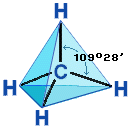 Валентный угол Н-С-Н равен 109о28'. Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей.
Валентный угол Н-С-Н равен 109о28'. Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей. 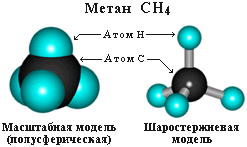
Для записи удобно использовать пространственную (стереохимическую) формулу.
В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3-атома углерода образуют более сложную пространственную конструкцию: 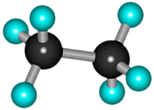 Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. Это можно показать на примере н-бутана или н-пентана:
Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. Это можно показать на примере н-бутана или н-пентана: 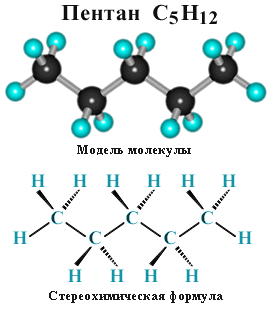
12. Гомологический ряд алканов Алканы представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (-CH2-). Такая последовательность соединений называется гомологическим рядом , отдельные члены этого ряда – гомологами, а группа атомов, на которую различаются соседние гомологи, – гомологической разностью. Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей цепочке новый атом углерода и дополняя его оставшиеся валентности до 4-х атомами водорода. CH4 или Н-СН2-Н – первый член гомологического ряда – метан (содержит 1 атом C); CH3-CH3 или Н-СН2-СН2-Н – 2-й гомолог – этан (2 атома С). Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного и суффикса -ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан и т.д. Гомологи отличаются молекулярной массой, и физическими характеристиками. С ростом молекулярной массы в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов : повышаются температуры кипения и плавления, увеличивается плотность. Алканы от СН4 до С4Н10– газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества. Имея одинаковый качественный состав и однотипные химические связи, гомологи обладают сходными химическими свойствами. Поэтому, зная химические свойства одного из членов гомологического ряда, можно предсказать химическое поведение и других членов этого ряда. Для получения гомологов используются общие методы синтеза. Свою номенклатуру имеют радикалы(углеводородные радикалы)
| Алкан - ан СnH2n+2 | Радикал (R) – ил СnH2n+1 | ||
| ФОРМУЛА | НАЗВАНИЕ | ФОРМУЛА | НАЗВАНИЕ |
 | метан | 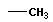 | Метил |
Число одинаковых заместителей указывают при помощи множительных приставок: два – «ди», три – «три», четыре – «тетра» и тд.
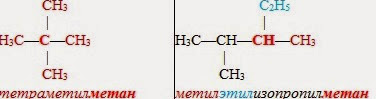
13. 1. По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
2. Систематическая номенклатура Правила систематической номенклатуры:
1. В формуле молекулы алкана выбираем главную цепь — самую длинную.
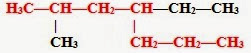 2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). Заместители перечисляем по алфавиту.
2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). Заместители перечисляем по алфавиту.
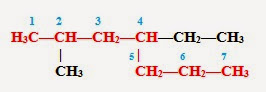 3. Называем углеводород: вначале указываем (цифрой) место расположения заместителя, затем называем этот заместитель (радикал), а в конце добавляем название главной (самой длинной) цепи. Таким образом, углеводород может быть назван: 2 - метил - 4 – этилгептан.
3. Называем углеводород: вначале указываем (цифрой) место расположения заместителя, затем называем этот заместитель (радикал), а в конце добавляем название главной (самой длинной) цепи. Таким образом, углеводород может быть назван: 2 - метил - 4 – этилгептан.
14. Получение алканов Алканы выделяют из природных источников
(природный и попутный газы, нефть, каменный уголь). Используются также синтетические методы.
1. Крекинг нефти (промышленный способ) 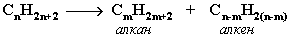 При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Получается ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Получается ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
2. Гидpиpование непpедельных углеводоpодов: 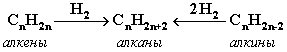
3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni): 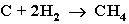
4.Из синтез-газа (СО + Н2) получают смесь алканов: 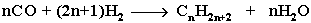
5. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:
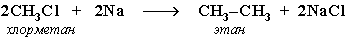
(реакция Вюpца)
6.Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма) 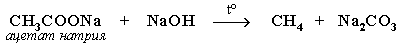
б) электролиз по Кольбе 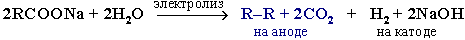
7. Разложение карбидов металлов (метанидов) водой: 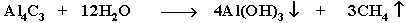
14. Химические свойства алканов.В нормальных условиях алканы – химически инертные соединения,не реагируют с H2SO4 и азотной кислотой, с концентрированной щелочью, с перманганатом калия. Устойчивость объясняется прочностью связей и их неполярностью. Соединения не склонны к реакциях разрыва связи (реакция присоединения), для них свойственно замещение. 1. Галогенированиеалканов. Под воздействием кванта света начинается радикальное замещение (хлорирование) алкана. Общая схема: 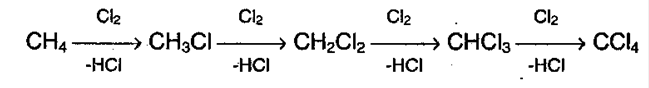 Реакция идет по цепному механизму, в которой различают: А) Инициирование цепи:
Реакция идет по цепному механизму, в которой различают: А) Инициирование цепи: 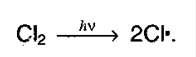 Б) Рост цепи:
Б) Рост цепи: 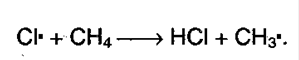
В) Обрыв цепи: 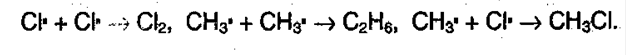 Суммарно можно представить в виде:
Суммарно можно представить в виде: 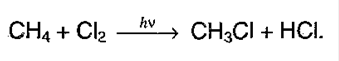
2. Нитрование (реакция Коновалова)алканов. Реакция протекает при 140 °С:
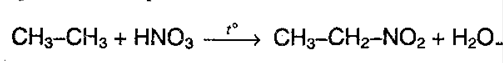
Легче всего реакция протекает с третитичным атомом углерода, чем с первичным и вторичным.
3. Изомеризацияалканов. При конкретных условиях алканы нормального строения могут превращаться в разветвленные: 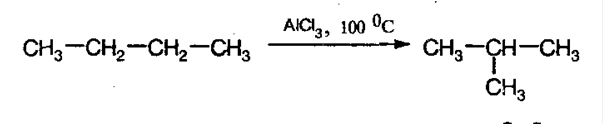
4. Крекингалканов. При дейсвии высоких температур и катализаторов высшие алканы могут рвать свои связи, образуя алкены и алканы более низшие: 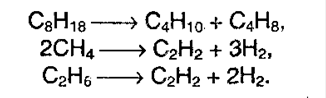
5. Окислениеалканов. В различных условиях и при разных катализаторах окисление алкана может привести к образованию спирта, альдегида (кетона) и уксусной кислоты. В условиях полного окисления реакуия протекает до конца – до образования воды и углекислого газа: 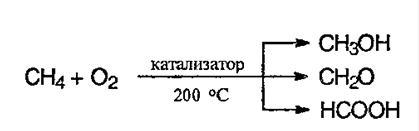
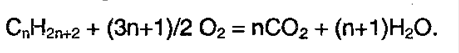
15. Применение алканов. Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива.
Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. Вазелиновое масло - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике. Вазелин -пpименяется для пpиготовления мазей, используемых в медицине. Паpафин - белая твеpдая масса без запаха и вкуса (т. пл. 50-70 °C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ. Нормальные предельные углеводороды используются как питательный субстрат в синтезе белка из нефти. Галогенопроизводные алканов используются как растворители, хладоагенты и сырье для дальнейших синтезов. Предельные улеводороды являются базой для получения разнообразных соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
16.Алкены ( олефины) – это углеводороды, в молекулах которых содержатся атомы углерода, соединенные между собой двойной связью. Простейший представитель — этилен С 2Н 4, общая формула гомологического ряда этиленовых углеводородов С nН 2n(при п >= 2).
Систематические названия производятся от корней названий алканов с заменой суффикса – ан -> – ен: 
Сохраняются также традиционные названия с заменой суффикса – анна – илен: С 2Н 4– этилен, С 3Н 6– пропилен, С 4Н 8– бутилен. Положение двойной связи С=С в изомерах строения (начиная с алкена С 4) указывается цифрой посленазвания: 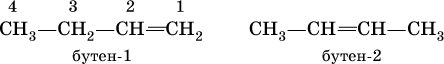 Радикал этилена – этенил СН 2=СН – обычно называют винил,пропена – пропенил СН 2=СН – СН 2– именуют аллил.
Радикал этилена – этенил СН 2=СН – обычно называют винил,пропена – пропенил СН 2=СН – СН 2– именуют аллил.
Алкадиены (диены)– непредельные алифатические углеводороды, молекулы которых содержат две двойные связи.
Общая формула алкадиенов СnH2n-2. Бывают с: 1) сопряженным расположением двойных связей
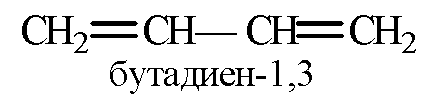
2) кумулированным расположением двойных связей
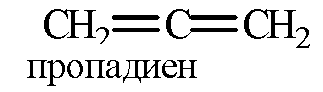
3) изолированным расположением двойных связей
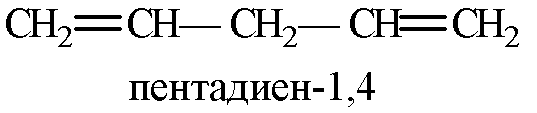
17. Строение двойной связи С=С
Двойная связь является сочетанием s- и p-связей . s-Связь возникает при осевом перекрывании sp2-гибридных орбиталей, а p-связь – при боковом перекрывании р-орбиталей соседних sp2-гибридизованных атомов углерода. Образование связей в молекуле этилена можно изобразить следующей схемой: С=С s-связь (перекрывание 2sp2-2sp2) и p-связь (2рz-2рz)
С–Н s-связь (перекрывание 2sp2-АО углерода и 1s-АО водорода)
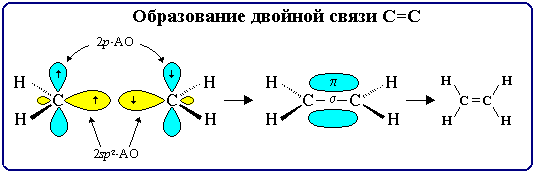 s-Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула этилена имеет плоское строение:
s-Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула этилена имеет плоское строение:
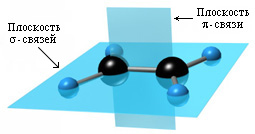
Модели молекулы этилена
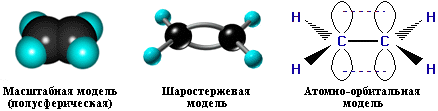
По своей природе p-связь отличается от s-связи: p-связь менее прочная из за меньшей эффективности перекрывания р-орбиталей.
В молекуле пропилена СН2=СН–СН3 в одной плоскости лежат 6 атомов: два sp2-атома углерода и четыре связанные с ними атома (3 атома Н и атом С группы СН3). Вне этой плоскости находятся атомы водорода в метильной группе СН3, имеющей тетраэдрическое строение, т.к. этот атом углерода sp3-гибридизован. 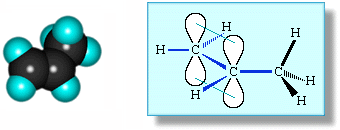 Аналогичное строение имеют другие алкены.
Аналогичное строение имеют другие алкены.
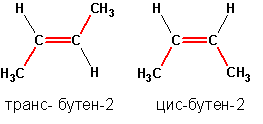
18. Пространственная изомерия (стереоизомерия)возникает в результате различий в пространстве. конфигурации молекул, имеющих одинаковое хим. строение. Пространственными изомерами являются оптические (зеркальные) и цис-транс-изомеры, пространственными изомерами может обладать бутен-2, существующий в природе в виде цис- и транс-бутенов-2:
 Пространственная изомерия появляется, в частности, тогда, когда углерод имеет четыре разных заместителя:
Пространственная изомерия появляется, в частности, тогда, когда углерод имеет четыре разных заместителя:
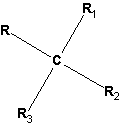
Если поменять местами любые два из них, получается другой пространственный изомер того же состава. Физико-химические свойства таких изомеров существенно различаются. Соединения такого типа отличаются способностью вращать плоскость пропускаемого через раствор таких соединений поляризованного света на определенную величину. При этом один изомер вращает плоскость поляризованного света в одном направлении, а его изомер – в противоположном. Вследствие таких оптических эффектов этот вид изомерии называют оптической изомерией.
Способы получения алкенов
– крекинг алканов C8H18 ––> C4H8 + C4H10; (термический крекинг при 400-700 oС)
октан бутен бутан
– дегидрирование алканов C4H10 ––> C4H8 + H2; (t, Ni)
бутан бутен водород
– дегидрогалогенирование галогеналканов C4H9Cl + KOH ––> C4H8 + KCl + H2O;
хлорбутан гидроксид бутен хлорид вода
калия калия
– дегидрогалогенирование дигалогеналканов 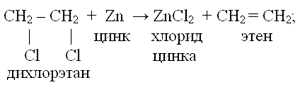
– дегидратация спиртов С2Н5ОН ––> С2Н4 + Н2О (при нагревании в присутствии концентрированной серной кислоты)
При реакиях дегидрирования, дегидратации, дегидрогалогенирования и дегалогенирования нужно помнить, что водород отрывается от менее гидрогенизированных атомов углерода (правило Зайцева, 1875 г.)
20. Химические свойства алкеновНаличие в молекулах этиленовых углеводородов двойной углерод – углеродной связи обуславливает следующие особенности этих соединений: – наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные только в результате реакций присоединения-основной чертой химического поведения олефинов; – двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной 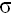 - и одной
- и одной 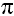 -связи, которая достаточно легко поляризуется.
-связи, которая достаточно легко поляризуется.

Физические свойства полиэтилена ПНД (HDPE). Полиэтилен HDPE представляет собой твердый материал, с воскообразной на ощупь поверхностью. HDPE обладает высокой вязкостью, гибкостью, растяжимостью и эластичностью. Материал легче воды. Материал также обладает хорошими диэлектрическими свойствами, а стойкость к радиоактивным излучениям одна из самых высоких среди полимерных материалов. Полиэтилен физиологически безвреден и годен к контакту с пищевыми продуктами.
22. Особенности степени полимеризации:
а) полиэтилен с короткими цепями (n = 20) является жидкостью, обладающей смазочными свойствами;
б) полиэтилен с длиной цепи в 1500–2000 звеньев представляет собой твердый, но гибкий пластический материал, из которого можно получать пленки, изготовлять бутылки;
в) полиэтилен с длиной цепи 5–6 тыс. звеньев является твердым веществом, из которого можно готовить литые изделия, жесткие трубы, прочные нити.
Условия протекания реакций полимеризации весьма различны:
1) в некоторых случаях необходимы катализаторы и высокое давление;
2) главным фактором является строение молекулы мономера;
3) в реакцию полимеризации вступают непредельные (ненасыщенные) соединения за счет взрыва кратных связей.
В лабораторных условиях полиэтилен получают при нагревании этилового спирта с водоотнимающими веществами (концентрированной серной кислотой, оксидом фосфора (v) и другими): С2Н5ОН -> СН2=СН2 + Н2О.
23. Полипропилен (РР) получают полимеризацией газа пропилена с применением катализаторов. Получившийся материал, благодаря своим физико-химическим свойствам, нашел широчайшее применение в различных отраслях промышленности, в том числе на нашем предприятии при производстве емкостей и резервуаров. ФИЗИЧЕСКИЕ СВОЙСТВА ПОЛИПРОПИЛЕНА Полипропилен обладает высокой ударной вязкостью и повышенной износостойкостью, годен к контакту с питьевой водой и пищевыми продуктами, водонепроницаем, обладает коррозионной стойкостью, низкой теплопроводностью. Полипропилен не обладает запахом, не тонет в воде, в огне горит без дыма, запах при горении острый и сладковатый, плавится каплями. По способу полимеризации полипропилен делится на гомополимер, получаемый полимеризацией одинаковых мономеров, и сополимер, получаемый полимеризацией разных мономеров. Гомополимеры (PP-H) обладают высокой твердостью, жесткостью и прочностью на растяжение, но при температуре близкой к нулю становятся хрупкими. В состав сополимеров (PP-В/PP-C) входит полиэтилен, поэтому сополимеры обладают высокой пластичностью и могут использоваться при температуре до -20°С, но по сравнению с гомополимером менее устойчивы к высоким температурам. Полипропилен обладая высокой химической устойчивостью и прочностью, является универсальным материалом при изготовлении гальванических ванн. На полипропилен незначительное влияние оказывает ионизирующее облучение, поэтому материал широко используется в медицине. Для защиты от старения в полипропилен добавляют малые дозы низкомолекулярных добавок – стабилизаторы. Для защиты полипропилена от светового старения применяются светостабилизаторы (ультрафиолетовые стабилизаторы).
24 .Полимеризация диеновых соединений В упрощенном виде реакцию полимеризации бутадиена -1,3 по схеме 1,4 присоединения можно представить следующим образом:
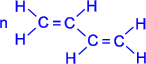 | ––––® | 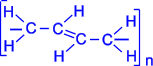 . . |
В полимеризации участвуют обе двойные связи диена. В процессе реакции они разрываются, пары электронов, образующие s- связи разобщаются, после чего каждый неспаренный электрон участвует в образовании новых связей: электроны второго и третьего углеродных атомов в результате обобщения дают двойную связь, а электроны крайних в цепи углеродных атомов при обобщении с электронами соответствующих атомов другой молекулы мономера связывают мономеры в полимерную цепочку.
Элементная ячейка полибутадиена представляется следующим образом :
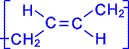 .
.
Наиболее ценные в практическом отношении продукты получаются при стереорегулярной (иными словами, пространственно упорядоченной) полимеризации диеновых углеводородов по схеме. Например, цис- полибутадиен
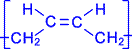 .
.
Получение алкинов
Триолы
| Глицерин (пропантриол-1,2,3) | ||
| Формула | Модели молекулы | |
| шаростержневая | полусферическая | |
| HOCH2-СH(OH)-CH2OH | 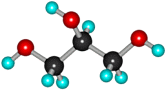 | 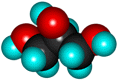 |
Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой. Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
44. Фенол – это химическое соединение которое имеет формулу C5H6OH и является искусственно выведенным соединением. Фенол является веществом с кристаллической структурой с запахом похожим на гуашь, является крайне токсичным веществом. Под воздействием воздуха фенол может менять свой цвет, что проявляется в изменении цвета кристаллов: по началу они имеют розовый цвет, в последствии переходя в бурый. И именно это свойство позволяет использовать это вещество в производстве красителей.
Стоит отметить также и другие химические свойства фенола – это его низкая температура плавления, и способность растворяться в различного рода растворителей, как органических, так и в неорганических. С течением лет, фенол, который использовали в производстве различных строительных материалах, не теряет свои токсичные свойства, и его опасность для человека не снижается. Фенол негативно влияет на сердечно-сосудистую систему, нервную и на другие внутренние органы, такие как почки, печень и др. Во многих странах его использование в производстве товаров домашнего обихода, категорически запрещено в виду его токсичной активности.
45. Применение фенола в промышленности. В этом веществе были также открыты его антисептические свойства: стало понятно что его можно использовать в борьбе против бактерий, стерилизовать медицинские инструменты, кабинеты и др. Медикаменты с этим веществом применяются как внутрь наружно, так и внутрь. Плюс, фенол обладает обезболивающим свойством. На его основе делается всем известный аспирин и его применение имеет место в производстве лекарств для больных туберкулезом. Фенол используется в генной инженерии для выделения ДНК. В легкой промышленности его используют для обработки кожи животных, дезинфицируя её. Для защиты сельскохозяйственных культур тоже используется фенол. Но главную роль фенол играет в химической промышленности. Его используют для производства различного рода пластмасс и других синтетических волокон. По сей день некоторые детские игрушки производятся с добавлением этого вещества, что делает конечный продукт не безопасным для здоровья человека. Фенол применяется для приготовления красителей, пикриновой кислоты (ВВ) и особенно для получения пластмасс — фенолформальдегидных смол. Растворы фенола используют для дезинфекции. Производные фенола — гербициды контактного действия. Их применение приводит к отмиранию тех тканей растений, на которые они нанесены. Воздействие производных фенола на растительный организм весьма многообразно. Установлено, что производные фенола оказывают действие на окислительное фосфо-рилирование и гликолиз, на процессы брожения и на белки плазмы. В невысоких концентрациях препараты стимулируют процессы дыхания, а при высоких дозах тормозят и вызывают денатурацию белков. В модельных опытах фенольные соединения в высоких концентрациях тормозят ростовые процессы, хотя не так уж редко один и тот же фенол в малых дозах усиливает рост, а в больших — угнетает.
46. Два класса органических веществ альдегиды и кетоны — характеризуются присутствием в молекуле карбонильной группы, или радикала карбонила, >С=О. В альдегидах атом углерода этого радикала связан не менее чем с одним атомом водорода, так что получается одновалентный радикал
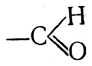 называемый также альдегидной группой. В кетонах карбонильная группа связана с двумя углеводородными радикалами и называется также кетогруппой или оксо-группой.
называемый также альдегидной группой. В кетонах карбонильная группа связана с двумя углеводородными радикалами и называется также кетогруппой или оксо-группой.
47 Строение Альдегиды — органические вещества, молекулы которых содержат карбонильную группу С=0, соединенную с атомом водорода и углеводородным радикалом.Общая формула альдегидов имеет вид
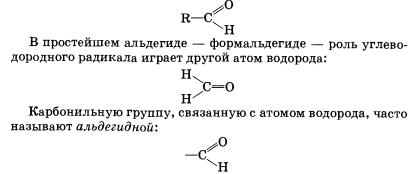
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.Очевидно, общая формула кетонов имеет вид
O
II
R1—C—R2Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
O
II
СН3-С-СН3
ацетон
Номенклатура
Систематические названия одноосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса -овая и слова кислота.
Гомологический ряд
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
| Муравьиная кислота | Метановая кислота | HCOOH | Формиаты |
| Уксусная кислота | Этановая кислота | CH3COOH | Ацетаты |
| Пропионовая кислота | Пропановая кислота | C2H5COOH | Пропионаты |
| Масляная кислота | Бутановая кислота | C3H7COOH | Бутираты |
| Валериановая кислота | Пентановая кислота | C4H9COOH | Валераты |
| Капроновая кислота | Гексановая кислота | C5H11COOH | Капраты |
| Энантовая кислота | Гептановая кислота | C6H13COOH | Энантоаты |
| Каприловая кислота | Октановая кислота | C7H15COOH | Каприлаты |
| Пеларгоновая кислота | Нонановая кислота | C8H17COOH | Пеларогоаты |
| Каприновая кислота | Декановая кислота | C9H19COOH | Капринаты |
| Ундециловая кислота | Ундекановая кислота | C10H21COOH | Ундеканоаты |
| Лауриновая кислота | Додекановая кислота | C11H23COOH | Лаураты |
| - | Тридекановая кислота | C12H25COOH | Тридеканоаты |
| Миристиновая кислота | Тетрадекановая кислота | C13H27COOH | Миристиаты |
| - | Пентадекановая кислота | C14H29COOH | Пентадеканоат |
| Пальмитиновая кислота | Гексадекановая кислота | C15H31COOH | Пальмитаты |
| Маргариновая кислота | Гептадекановая кислота | C16H33COOH | Маргараты |
| Стеариновая кислота | Октадекановая кислота | C17H35COOH | Стеараты |
| - | Нонадекановая кислота | C18H37COOH | Нонадеканоаты |
| Арахиновая кислота | Эйкозановая кислота | C19H39COOH | Арахаты |
| - | Генэйкозановая кислота | C20H41COOH | Генэйкозаноаты |
| Бегеновая кислота | Докозановая кислота | C21H43COOH | Бегенаты |
| - | Трикозановая кислота | C22H45COOH | Трикозаноаты |
| Лигноцериновая кислота | Тетракозановая кислота | C23H47COOH | Лигноцераты |
| - | Пентакозановая кислота | C24H49COOH | Пентакозаноаты |
| Церотиновая кислота | Гексакозановая кислота | C25H51COOH | Церотитаты |
| - | Гептакозановая кислота | C26H53COOH | Гептакозаноаты |
| Монтановая кислота | Октакозановая кислота | C27H55COOH | Монтаноаты |
58. ФИЗИЧЕСКИЕ СВОЙСТВА карбоновых кислот Низшие монокарбоновые кислоты представляют собой бесцветные жидкости, высшие алифатические и ароматические кислоты — твердые вещества. Первые гомологи — муравьиная, уксусная и пропионовая кислоты — обладают резким раздражающим запахом, с водой смешиваются в любых соотношениях. По мере увеличения гидрофобной углеводородной части молекулы растворимость в воде уменьшается. Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов с тем же числом атомов углерода. Это объясняется тем, что карбоновые кислоты в жидком состоянии образуют ассоциаты за счет межмолекулярных водородных связей
Крахмал
Крахмал относится к полисахаридам. Молекулярная масса этого вещества точно не установлена, но известно, что очень велика (порядка 100000) и для разных образцов может быть различна. Поэтому формулу крахмала, как и других полисахаридов, изображают в виде (С6Н10О5)n. Для каждого полисахарида n имеет различные значения.
Физические свойства
Крахмал представляет собой безвкусный порошок, нерастворимый в холодной воде. В горячей воде набухает, образуя клейстер.
Крахмал широко распространен в природе. Он является для различных растений запасным питательным материалом и содержится в них в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 86%), пшеницы (до 75%), кукурузы (до 72% ), а также клубни картофеля (до 24% ). В клубнях картофеля крахмальные зерна плавают в клеточном соке, а в злаках они плотно склеены белковым веществом клейковиной. Крахмал является одним из продуктов фотосинтеза.
Химические свойства
1) При действии ферментов или при нагревании с кислотами (ионы водорода служат катализатором) крахмал, как и все сложные углеводы, подвергается гидролизу. При этом сначала образуется растворимый крахмал, затем менее сложные вещества — декстрины. Конечным продуктом гидролиза является глюкоза. Можно выразить суммарное уравнение реакции следующим образом:
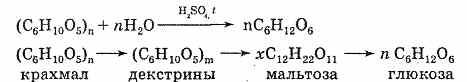
Происходит постепенное расщепление макромолекул. Гидролиз крахмала — его важное химическое свойство.
-глюкозы. Процесс образования крахмала можно выразить так (реакция поликонденсации):a2) Крахмал не дает реакции «серебряного зеркала», но ее дают продукты его гидролиза. Макромолекулы крахмала состоят из многих молекул циклической
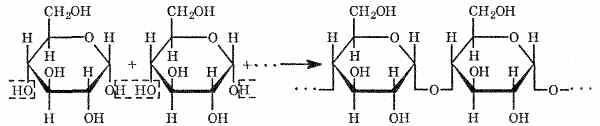
3) Характерной реакцией является взаимодействие крахмала с растворами иода. Если к охлажденному крахмальному клейстеру добавить раствор иода, то появляется синее окрашивание. При нагревании клейстера оно исчезает, а при охлаждении появляется вновь. Этим свойством пользуются при определении крахмала в пищевых продуктах. Так, например, если каплю иода нанести на срез картофеля или ломтик белого хлеба, то появляется синее окрашивание.
Применение
Крахмал является основным углеводом пищи человека, он в больших количествах содержится в хлебе, крупах, картофеле, овощах. В значительных количествах крахмал перерабатывается на декстрины, патоку, глюкозу, которые используются в кондитерской промышленности. Крахмал используется как клеящее средство, применяется для отделки тканей, накрахмаливания белья. В медицине на основе крахмала готовят мази, присыпки и т.д.
Биологическое значениеИз всех углеводов в рационе человека крахмал занимает наибольшую долю, т.к. он содержится во всех основных пищевых продуктах растительного происхождения. Главными его источниками являются мучные изделия и крупы. Крахмалсодержащими являются все продукты, сделанные из муки: хлеб, макароны, вермишель, хлебобулочные и многие кондитерские изделия, а также картофель, кукуруза, горох, рис, крупы и пр. Всего на сегодняшний день для получения крахмалов используется более 50 видов растений, но наиболее популярен в России картофельный крахмал, калорийность которого достигает 300 ккал на 100 грамм (у кукурузного – 330 ккал/100 .
Целлюлоза, или клетчатка
Целлюлоза — еще более распространенный углевод, чем крахмал. Из него состоят в основном стенки растительных клеток. В древесине содержится до 60%, в вате и фильтровальной бумаге — до 90% целлюлозы.
Физические свойства
Чистая целлюлоза — белое твердое вещество, нерастворимое в воде и в обычных органических растворителях, хорошо растворимо в концентрированном аммиачном растворе гидроксида меди (II) (реактив Швейцера). Из этого раствора кислоты осаждают целлюлозу в виде волокон (гидратцеллюлоза). Клетчатка обладает довольно большой механической прочностью.
Состав и строение
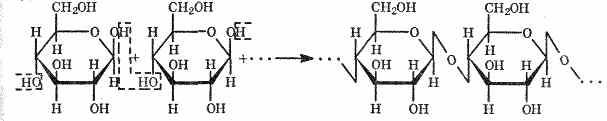
Состав целлюлозы, так же как и крахмала, выражают формулой (С6Н10О5)n. Значение n в некоторых видах целлюлозы достигает 10-12 тыс., а молекулярная масса доходит до нескольких миллионов. Молекулы ее имеют линейное (неразветвленное) строение, вследствие чего целлюлоза легко образует волокна. Молекулы же крахмала имеют как линейную, так и разветвленную структуру. В этом основное отличие крахмала от целлюлозы.
-глюкозы. Процесс образования фрагмента макромолекулы целлюлозы можно изобразить схемой:b-глюкозы, а макромолекулы целлюлозы — из остатков aИмеются различия и в строении этих веществ: макромолекулы крахмала состоят из остатков молекул
Гидролиз клетчатки
Гидролиз клетчатки. Древесные опилки, желательно еловые, просушите в сушильном шкафу при температуре 105-110 °С до постоянного веса. Затем поместите 25 г сухих опилок в большую колбу и прилейте в нее 175 мл 55-процентного раствора серной кислоты (уд. вес 1,45). Жидкость кипятите в течение одного часа. Во время нагревания колбу встряхните несколько раз (осторожно). Через час в колбу налейте 1,5 л воды и продолжайте кипятить 2-2,5 часа. Происходит следующая реакция: (С6Н10О5)n + nH2O = nС6Н12O6. Когда жидкость остынет, фильтруйте через ткань. Фильтрат нейтрализуйте известковым молоком до тех пор, пока лакмус не даст отрицательную реакцию на кислоту. Определите при помощи жидкости Фелинга наличие глюкозы в полученном растворе. Для получения кристаллического сахара требуется обработать во много раз большее количество древесных опилок.
79. АМИНЫ– класс соединений, представляющий собой органические производные аммиака, в котором один, два или три атома водорода замещены органическими группами. Отличительный признак – наличие фрагмента R–N<, где R – органическая группа. В зависимости от числа органических групп, связанных с атомом азота, различают: первичные амины – одна органическая группа у азота RNH2 вторичные амины – две органических группы у азота R2NH, органические группы могут быть различными R'R"NH третичные амины – три органических группы у азота R3N или R'R"R"'N По типу органической группы, связанной с азотом, различают алифатические СH3 – N< и ароматические С6H5 – N< амины, возможны и смешанные варианты. По числу аминогрупп в молекуле амины делят на моноамины СH3 – NН2, диамины H2N(СH2)2NН2, триамины и т.д. Номенклатура аминов.к названию органических групп, связанных с азотом, добавляют слово «амин», при этом группы упоминают в алфавитном порядке, например, СН3NHС3Н7 – метилпропиламин, СН3N(С6Н5)2 – метилдифениламин. Правила допускают также составлять название, взяв за основу углеводород, в котором аминогруппу рассматривают как заместитель. В таком случае ее положение указывают с помощью числового индекса: С5Н3С4Н2С3Н(NН2)С2Н<
