Электролиз растворов и расплавов. Законы электролиза.
Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электролиз является одним из важнейших направлений в электрохимии.
Электрохимия принадлежит к числу тех немногих наук, дата рождения которых может быть установлена с высокой точностью. Это рубеж XVIII и XIX веков, когда благодаря знаменитым опытам итальянского физиолога Л. Гальвани и созданию итальянским физиком А. Вольта в 1799 г. «вольтова столба» – первого в истории человечества химического источника тока – были сформулированы проблемы, решение которых определило основные задачи электрохимии. «Без химии путь к познанию истинной природы электричества закрыт» – сказал М.В. Ломоносов. И, действительно, как бы следуя словам великого ученого, создавалась и развивается наука – электрохимия.
Еще в начале позапрошлого столетия было установлено, что при прохождении электрического тока через водные растворы солей происходят химические превращения, приводящие к образованию новых веществ. В результате этого, в начале прошлого века возникло научное направление по изучению электрохимических процессов в растворах и расплавах веществ – электрохимия. К концу семидесятых годов оно разделилось на два самостоятельных раздела – ионику, изучающую явления электропроводности и движения заряженных частиц под воздействием электрического поля, и электродику, изучающую явления происходящие непосредственно на поверхности электродов, когда через границу электрод-раствор (расплав) протекает электрический ток. Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими.
Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода.
Технический или прикладной электролиз характеризуется сложностью протекающих в промышленных условиях электролитических процессов, различными видами электролиза, их зависимостью от природы электролита, типа электролитической ванны, оптимизации самих электролизных процессов.
Электролитические процессы классифицируются следующим образом:
· получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.)
· получение металлов (литий, натрий, калий, берилий, магний, цинк, алюминий, медь и т.д.)
· очистка металлов (медь, серебро,…)
· получение металлических сплавов
· получение гальванических покрытий
· обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка)
· получение органических веществ
· электродиализ и обессоливание воды
· нанесение пленок при помощи электрофореза
Актуальность электролиза объясняется тем, что многие вещества получают именно этим способом. Например, такие металлы как никель, натрий, чистый водород и другие, получают только с помощью этого метода. Кроме того с его помощью электролиза относительно легко можно получить чистые металлы, массовая доля самого элемента в которых стремиться к ста процентам. В промышленности алюминий и медь в большинстве случаев получают именно электролизом. Преимущество этого способа в относительной дешевизне и простоте. Однако чтобы производство было наиболее выгодным: с наименьшими затратами электроэнергии и с наибольшим выходом продукции, необходимо учитывать различные факторы, влияющие на количество и качество продуктов электролиза (сила тока, плотность тока, температура электролита, материал электродов и др.).
На сегодняшний день большой популярностью пользуются различные предметы, покрытые драгоценными металлами. (позолоченные или посеребренные вещи).
Количественные характеристики электролиза * выражаются двумя законами Фарадея:
1) Масса вещества, выделяющегося на электроде *, прямо пропорциональна количеству электричества, прошедшего через электролит *.
2) При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам.
Эти два закона можно объединить в одном уравнении:
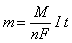 ,
,
где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе;
F – число Фарадея (F=96485 Кл/моль)
I – сила тока, А;
t – время, с;
M – молярная масса выделяющегося вещества, г/моль.
Величина 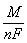 называется электрохимическим эквивалентом вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F=26,8 А×ч/моль.
называется электрохимическим эквивалентом вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F=26,8 А×ч/моль.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы вещества, реально выделенного на электроде, к теоретической и умноженное на 100%, называют выходом по току: 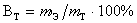 .
.
К тому же металлические изделия покрывают слоем другого металла электролитическим способом с целью защитить его от коррозии.
Таким образом, исследование электрохимических процессов, определение факторов, влияющих на них, установление новых способов использования процессов электролиза в промышленных условиях сохранило свою актуальность в наши дни.
В своей работе нами были определены следующие задачи:
– ознакомление с теоретическими основами электролитических процессов;
– определить влияние различных факторов на качественный и количественный состав продуктов электролиза;
– выделить области практического применения электролиза;
– экспериментально определить влияние качественного состава исходного электролита на состав продуктов электролиза.
электролиз раствор расплав
