Основные химические понятия: атомная и молекулярная масса, моль, молярная масса, степень окисления элемента, валентность.
Основные химические понятия: атомная и молекулярная масса, моль, молярная масса, степень окисления элемента, валентность.
Аомная масса- это масса атома, выраженных в атомных единицах, применяемых для масс молекул, атомов.
Молекулярная масса-эо масса молекулы, выраженная в атомных единицах массы.
Степень окисления-это условный показатель, характеризующий заряд атома в соединениях.
моль — это количество вещества, масса которого, выраженная в граммах, численно равняется его массе в атомных единицах массы
Моля́рная ма́сса — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента.
Степень окисления условный показатель, характеризующий заряд атома в соединениях
Вале́нтность— способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
Стехиометрические законы химии: Закон сохранения массы вещества, Закон кратных отношений, Закон постоянства состава вещества.
Закон сохранения массы веществ, позже (в 1748 г.) сформулированный М.В. Ломоносовым, подчинен закону атомно-молекулярного учения и объяснен с точки зрения последнего: общее число атомов остается постоянным до и после реакций.
NaOH + HCl = H2O + NaCl
40 + 37.5 18 + 59.5
77.5 77.5
Закон кратных отношений — один из стехиометрических законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие.
Закон постоянства составачистого вещества не зависит от способа получения этого вещества C2H5OH+3O2=2CO2+3H2O
H2O-пероксид водорода, H2O молекула состоит из 2 атомов H и 1атома O, т.е. по массе 11,1%H и 88,9%O.
3.Газовые законы. Условия их выполнения и приложение в химии.
Закон Авогадро и следствие из него
Следствие из закона Авогадро.
При одинаковых условиях 1 моль любого газообразного вещества занимает один и тот же объем, н.у. объем = 22,4л.
T = 273,15 К, P = 101325 Па = 760 мм.рт.ст. = 1 атом
Особенности газов:
Свободное движение молекул
Низкая плотность
Газы стремятся к безграничному распространению
1. Закон Бойля-Мириоттат при постоянной температуре объем данной массы газа обратно пропорционально давлению, T – cons,PV = const, V1\V2=p2\p1,V1P1=V2P2
Закон Гей – Люссана
P = const При постоянном давлении объем данной массы газа прямо пропорционально абсолютной температуре.
V1\V2=T1\T2
V = const при постоянном объеме давление данной массы газа прямо пропорционально абсолютной температуре. P1\P2=T1\T2
Объединенный газовый закон.
PV\T=P1V1\T1=P2V2\T2,const, PV\T=R, R-универсальная газовая постоянная,R=8,314 Дж\мольК,PV=nRT-уравнение Менделеева - Клайлерона
4.Основные классы неорганических соединений.
Оксиды – это соединения химических элементов с кислородом. Они делятся на солеобразующие и несолеобразующие. Солеобразующие оксиды делятся на основные, кислотные и амфотерные
Основания – это вещества содержащие гидроксогруппу ОН. Растворимые основания называются щелочами. Щелочи образуют щелочные и щелочноземельные металлы.
Кислоты – это соединения которые при диссоциации образуют токько катион Н+. Классификация кислот: одноосновный, двухосновные и т.д. кислородосодержащие и бескислородные.
Соли – это неорганическое соединения из катиона метала и аниона кислотного остатка.
Кислая соль (недостаток основания) и основная соль(неполное замещение гидрогсогруппы).
6.Принципы заполнения электронами орбиталей многоэлектронных атомов. Емкость и порядок заполнения электронных подуровней в атоме (на примере элементов 2-4 периодов).
Принцип наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией.
Атомные орбитали располагаются в порядке увеличения их энергии следующим образом: 1s2 <2s2 <2p6<3s2<3p6<4s2<3d10-4p6<5s2<4d10<5p6<6s2<4f14<5d10<6p6<7s2<5f14<6d10.
Строение В многоэлектронных атомах энергия орбиталей.
из уравнения Шредингера: 1) Принцип минимума энергии электроны заполняют орбитали по мере увелечения их энергии; 2) Если + n+l для двух орбиталей =, то электроны сначала занимают орбиталь с меньшим значением n; 3) принцип Паули в атоме не может быть двух электронов с одинаковым значением всех 4 квантовых чисел; 4) суммарное спиновое число на орбиталях одного подуровня должно быть max.
Рассмотрим заполнение трех орбиталей р-подуровня. Орбиталь принято обозначать графически в виде квадратиков или прямоугольников, называемых квантовыми ячейками, а электроны обозначают стрелками, направление которых противоположно. Первые три электрона заполнят три р-орбитали по-одному (холостые электроны) и с одинаковыми спинами (параллельные электроны)Последующие электроны будут заполнять эти же орбитали, но будут иметь противоположные спины. Два электрона с противоположными спинами, занимающие одну орбиталь, называют спаренными электронами. Не полностью заполненный подуровень или уровень называют ненасыщенным, а полностью заполненный – насыщенным.
Энтропия
Изменение энтальпии системы не может служить единственным критерием самопроизвольного осуществления химической реакции, поскольку многие эндотермические процессы протекают самопроизвольно. Иллюстрацией этого служит растворение некоторых солей (например, NH4NO3) в воде, сопровождающееся заметным охлаждением раствора. Необходимо учитывать еще один фактор, определяющий способность самопроизвольно переходить из более упорядоченного к менее упорядоченному (более хаотичному) состоянию.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики)
Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Энтропия связана с термодинамической вероятностью соотношением:
|
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии *) в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл. Для химической реакции изменение энтропии аналогично изменению энтальпии
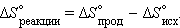 |
*) термин энтропия был введен Клаузиусом (1865 г.) через отношение Q / T (приведенное тепло).
Здесь ΔS° соответствует энтропии стандартного состояния. Стандартные энтропии простых веществ не равны нулю. В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка), поскольку W = 1.
Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. В табл. 4.1 приведены стандартные энтропии S° некоторых веществ.
энтропия зависит от:
· агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
· изотопного состава (H2O и D2O).
· молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
· строения молекулы (н-C4H10, изо-C4H10).
· кристаллической структуры (аллотропии) – алмаз, графит.
Изменения энтропии в химических реакциях
Энтропия одного моля вещества в его стандартном состоянии при соответствующей температуре называется стандартной молярной энтропией. Стандартная молярная энтропия обозначается символом S" и имеет размерность ДжК-1 моль-1. В табл. 5.12 указаны стандартные молярные энтропии ряда элементов и соединений при температуре 25°С. Отметим, что стандартная молярная энтропия газов, как правило, имеет намного большие значения по сравнению с энтропией твердых тел. Энтропия любого фиксированного количества вещества увеличивается в такой последовательности:
Твердое вещество= Жидкость= Газ
Стандартные молярные энтропии иногда называют абсолютными энтропиями. Они не являются изменениями энтропии, сопровождающими образование соединения из входящих в него свободных элементов. Следует также отметить, что стандартные молярные энтропии свободных элементов (в виде простых веществ) не равны нулю.
Третий закон термодинамике утверждает, что энтропия идеального ионного кристалла при температуре абсолютного нуля (О К) равна нулю.
Скорость химической реакции (v) характеризуется изменением концентрации реагирующих веществ (моль/л или моль/см3) в единицу времени (сек., мин., ч.).
Для гомогенной (однородной) системы скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образовавшихся в результате реакции за единицу времени в единице объема системы. Для гетерогенной системы скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образовавшихся в результате реакции за единицу времени на единице поверхности раздела фаз.
Факторы, влияющие на скорость химической реакции
1) Природа реагирующих веществ (характер связи в молекулах реагентов);
2) Концентрация реагентов;
3) Температура;
4) Катализатор;
5) Давление (для газов);
6) Излучение (ИК-, УФ-, рентгеновское, радиоактивное и др.);
7) Площадь поверхности раздела фаз (для гетерогенных реакций).
Влияние концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции, протекающей в однородной среде, пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
Например, для обратимой гомогенной реакции, выражающейся уравнением aA + bB ↔ cC + dD, в соответствии с законом действия масс, можно записать выражение скорости прямой и обратной реакций:
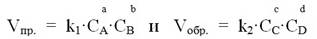
где k1 и k2 – константы скоростей прямой и обратной реакций.
Физический смысл константы скорости заключается в том, что она показывает численное значение скорости химической реакции, с которой реагируют вещества при их концентрации (или произведении концентраций), равной единице. Константа скорости реакции зависит от природы реагентов, температуры, наличия катализатора, но не зависит от концентрации реагентов.
Химическое равновесие
Химические реакции по признаку обратимости делятся на необратимые и обратимые. К необратимым реакциям относятся такие реакции, которые протекают до тех пор, пока один из реагентов полностью не израсходуются. Признаками необратимых реакций, протекающих в растворах, являются: а) выпадение осадка, б) образование газа, в) образование слабого электролита.
Обратимыми реакциями называются такие реакции, которые протекают одновременно в двух взаимно противоположных направлениях. Для подобных реакций вместо знака равенства пользуются противоположно направленными стрелками (↔).
С течением времени скорость любой реакции, измеряется по убывающим концентрациям исходных веществ, будет уменьшаться, так как по мере взаимодействия веществ их концентрации уменьшаются (скорость прямой реакции). Если реакция является обратимой, то по мере увеличения концентрации продуктов ее скорость будет возрастать (скорость обратной реакции). Как только скорости прямой и обратной реакций становятся одинаковыми, в системе устанавливается химическое равновесие и дальнейшее изменение концентраций всех веществ, находящихся в системе, прекращается.
Количественной характеристикой состояния равновесия является константа химического равновесия К, которая определяется отношением констант скоростей прямой и обратной реакцией
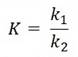
В подавляющем большинстве случаев константы скоростей прямой и обратной реакций не равны. Константа равновесия – постоянная при данной температуре величина и определяет соотношение между равновесными концентрациями продуктов реакции и исходных веществ, возведенных в степени их стехиометрических коэффициентов.
Например, для процесса N2 + 3H2 ↔ 2NH3
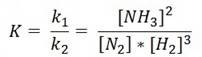
Квадратной скобкой обозначена концентрация каждого вещества в момент равновесия, так называемая равновесная концентрация.
Константа равновесия зависит от природы реагирующих веществ и температуры. Катализатор не влияет на состояние равновесия. Присутствие катализатора в системе лишь изменяет время его достижения. В состоянии равновесия система может находиться до тех пор, пока не изменится хотя бы одно из внешних воздействий: температура, концентрация одного из реагентов, давление (для газов). Изменения, происходящие в равновесной системе в результате внешних воздействий, определяются принципом подвижного равновесия (принцип Ле-Шателье): внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
На смещение равновесия оказывает влияние:
1) изменение температуры: эндотермический процесс ускоряется в большей степени при повышении температуры и, наоборот, при понижении температуры ускоряется экзотермический процесс;
2) изменение давления (для реакций, протекающих в газовой фазе): при повышении давления равновесие реакции смещается в направлении образования веществ, занимающих меньший объем, и, наоборот, понижение давления способствует процессу, сопровождающемуся увеличением объема. Если реакция протекает без изменения объема, то изменение давления в системе не оказывает влияние на химическое равновесие.
3) изменение концентрации: увеличение концентрации исходных веществ приводит к увеличению скорости прямой реакции, при этом протекающий в системе процесс завершится, когда скорости прямой и обратной реакций станут равны и установится новое равновесие. Уменьшение концентрации одного из продуктов реакции (вывод из системы) приводит к смещению равновесия в сторону его образования.
Критерием принципиальной осуществимости реакций является неравенство ΔGp, T < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, ΔGо298, H2O(г) = - 228,59 кДж/моль, а ΔGо298, AlI3(к) = -313;8 кДж/моль и, следовательно, при Т = 298 К и р = 1,013 • 105 Па возможны реакции, идущие по уравнениям:
Н2(г) + ½О2(г) = Н2О (1)
2Аl(к) + 3l2(к) = 2Аll3(к) (2)
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины для первой и воды для второй). Катализатор как бы снимает кинетический "тормоз", и тогда проявляется термодинамическая природа вещества, Скорость химических реакций зависит от многих факторов, основные из которых – концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе:
2SO2(г) + O2(г) = 2SO3(г)
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2]= a, [О2] = b, [SO3] = с. Согласно закону действия масс скорости v прямой и обратной реакции до изменения объема:
vпр = Ка2b; vобр = К1с2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b; [SO3] = 3с. При новых концентрациях скорости v’ прямой и обратной реакции:
v’пр = К(3а)2(3b) = 27Ка2b; v’обр = К1(3с)2 = 9К1с2.
Отсюда:
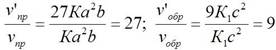
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
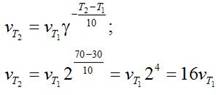
Следовательно, скорость реакции νТ2 при температуре 70оС больше скорости реакции νТ1 при температуре
30оС в 16 раз.
24. Изобарно-изотермический потенциал. Энтропийный и энтальпийный факторы процессов. Методы оценки возможности протекания химических процессов: по изменению энтальпии и энтропии, по изобарным потенциалам образования веществ.
Потенциалы термодинамические, определённые функции объёма (V), давления (р), температуры (Т), энтропии (S), числа частиц системы (N)и др. макроскопических параметров (xi), характеризующих состояние термодинамической системы. К П. т. относятся: внутренняя энергия U = U (S, V, N, xi); энтальпия Н = Н (S, р, N, xi); Гельмгольцева энергия (свободная энергия, или изохорно-изотермический потенциал, обозначается А или F) F = F (V, T, N, xi), Гиббсова энергия (изобарно-изотермический потенциал, обозначается Ф или G) G = G (p, Т, N, xi) и др. Зная П. т. как функцию указанных параметров, можно получить путём дифференцирования П. т. все остальные параметры, характеризующие систему, подобно тому как в механике можно определить компоненты действующих на систему сил, дифференцируя потенциальную энергию системы по соответствующим координатам. П. т. связаны друг с другом следующими соотношениями: F = U — TS, Н = U + pV, G = F + pV. Если известен какой-либо один из Т. п., то можно определить все термодинамические свойства системы, в частности получить уравнение состояния. При помощи П. т. выражаются условия термодинамического равновесия системы и критерии его устойчивости).
Совершаемая термодинамической системой в какой-либо процессе работа определяется убылью П. т., отвечающего условиям процесса. Так, в условиях теплоизоляции (адиабатический процесс, S = const) элементарная работа dA равна убыли внутренней энергии: dA = — dU. При изотермическом процессе (Т = const) dA = — dF (в этом процессе работа совершается не только за счёт внутренней энергии, но и за счёт поступающей в систему теплоты). Часто процессы в системах, например химические реакции, идут при постоянных р и Т. В этом случае элементарная работа всех термодинамических сил, кроме сил давления, равна убыли термодинамического потенциала Гиббса (G), т. е. dA' = — dG.
Равенство dA = — dU выполняется как для квазистатических (обратимых) адиабатических процессов, так и для нестатических (необратимых). В остальных же случаях работа равна убыли П. т. только при квазистатических процессах, при нестатических процессах совершаемая работа меньше изменения П. т. Теоретическое определение П. т. как функций соответствующих переменных составляет основную задачу статистической термодинамики (см. Статистическая физика).
Метод П. т. широко применяется для получения общих соотношений между физическими свойствами макроскопических тел и анализа термодинамических процессов и условий равновесия в физико-химических системах. Термин "П. т." ввёл французский физик П. Дюгем (1884), сам же основатель метода П. т. Дж. У. Гиббс пользовался в своих работах термином "фундаментальные функции".
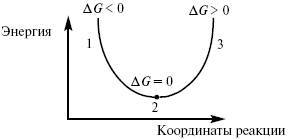
Скорость химической реакции
Скорость химической реакции, величина, характеризующая интенсивность реакции химической. Скоростью образования продукта реакции называется количество этого продукта, возникающее в результате реакции за единицу времени в единице объёма (если реакция гомогенна) или на единице площади поверхности (если реакция гетерогенна). Для исходных веществ аналогичным образом определяется скорость их расходования. Количества веществ выражают в молях. Тогда скорости образования продуктов и расходования исходных веществ относятся как стехиометрия, коэффициенты этих веществ в уравнении реакции. Например, в случае реакции N2 + ЗН2 = 2NH3 скорость расходования водорода в 3 раза, а скорость образования аммиака в 2 раза больше скорости расходования азота. Отношение скорости образования продукта реакции, или скорости расходования исходного вещества, к соответствующему стехиометрическому коэффициенту называется С. х.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
Cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции ( I ) этот закон выразится уравнением
v = kcA cB , (1)
где сА и сВ - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.
Из уравнения (1) нетрудно установить физический смысл константы скорости k : она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или когда их произведение равно единице.
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.
Влияние температуры .
Зависимость скорости реакции от температуры определяетсяправилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
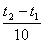
vt 2 = vt 1 γ ,
где vt 1 , vt 2 - скорости реакции соответственно при начальной ( t 1 ) и конечной ( t 2 ) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
27 Понятие о каталитических реакциях.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.
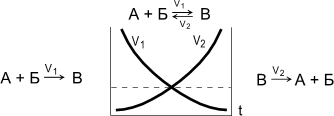 |
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
| V1 | ||
| A + Б | | В |
| V2 |
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
| V1 | |||
| A + Б | | В | ; увеличение P приводит к V1 > V2 |
| V2 | |||
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
| V1 | ||
| A + Б | | В + Q, то увеличение tC приводит к V2 > V1 |
| V2 |
| V1 | ||
| A + Б | | В - Q, то увеличение tC приводит к V1 > V2 |
| V2 |
3. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Увеличение концентраций исходных веществ [A] или [Б] или [А] и [Б]: V1 > V2.
4. Катализаторы не влияют на положение равновесия.
29 Характеристика химического равновесия. Константа химического равновесия. Расчет константы равновесия по изменению стандартного изобарного потенциала. Сдвиг химического равновесия.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
PH воды
Для удобства, концентрации [H+] и [HO-] выражают в виде водородного показателя pH и гидроксильного показателя pOH. pH и pOH - это отрицательные десятичные логарифмы концентраций [H+] и [HO-] (правильнее использовать не концентрацию, а активность) соответственно:
pH = -lg[H+]
pOH = -lg[OH-]
Прологарифмируя уравнение [H+] • [HO-] = 10-14 получим:
lg[H+] + lg[OH-] = -14
-lg[H+] - lg[OH-] = 14
pH + pOH = 14
Получившаяся сумма pH и pOH, также как и произведение, которое логарифмировали, является постоянной и равна 14, так если pH=3 то pOH=11 (pH и pOH могут быть и отрицательными, и если pH=-1 тогда pOH=15).
В зависимости от pH растворы делят на нейтральные, кислые и щелочные. При pH=7 раствор нейтральный, при pH<7 - кислый, при pH>7 - щелочной.
От pH раствора очень сильно зависит протекание многих химических реакций, как на уровне процессов проводящихся в лаборатории и на производстве, так и на уровне реакций в живых организмах, поэтому химикам и биологам с водородным показателем иметь дело приходится очень часто. Все обитатели природных вод и почв адаптированы к определенному водородному показателю, и в случаи его изменения могут погибнуть. Большинство живых организмов могут существовать лишь в средах, близких к нейтральным. Отчасти это связано с тем, что под действием ионов H+ и OH- многие белки, содержащие кислотные или основные группы, изменяют свою конфигурацию и заряд. А в сильнокислой и сильнощелочной средах рвётся пептидная связь, которая соединяет отдельные аминокислотные остатки в длинные белковые цепи. Из-за этого ультраосновные (сильнощелочные) растворы вызывают щелочные ожоги кожи и разрушают шёлк и шерсть, состоящие из белка. Все живые организмы вынуждены поддерживать во внутриклеточных жидкостях определённое значение рН. От величины водородного показателя почвенного раствора зависит урожайность различных культурных растений. На кислых почвах с pH=5-5,5 не развиваются проростки ячменя, но хорошо развивается картофель.
Ионное произведение воды,произведение концентраций (точнее активностей) ионов водорода Н+ и ионов гидроксила OH— в воде или в водных растворах: KB = [Н+] [ОН—]
Водородный показатель, pH, отрицательный десятичный логарифм концентрации (точнее, активности) ионов водорода (в г-ион/л) в данном растворе:
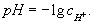
Основные химические понятия: атомная и молекулярная масса, моль, молярная масса, степень окисления элемента, валентность.
Аомная масса- это масса атома, выраженных в атомных единицах, применяемых для масс молекул, атомов.
Молекулярная масса-эо масса молекулы, выраженная в атомных единицах массы.
Степень окисления-это условный показатель, характеризующий заряд атома в соединениях.
моль — это количество вещества, масса которого, выраженная в граммах, численно равняется его массе в атомных единицах массы
Моля́рная ма́сса — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента.
Степень окисления условный показатель, характеризующий заряд атома в соединениях
Вале́нтность— способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
