Моль. молярная масса. закон авогадро
В качестве единицы количества вещества в химии используют моль. Моль – количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов и др.), сколько содержится атомов в 0,012 кг изотопа углерода 12С.Это число точно определено, составляет 6,02.1023 моль-1 и носит название постоянная Авогадро.Обозначается количество вещества символом nB; например, nCaO= 2 моль, т.е. количество вещества оксида кальция равно 2 моль, т.е. содержит 2• 6,02.1023=12,04.1023 формульных единиц СаО.
Массу одного моля вещества В называют молярной массой (обозначение МВ). Единицами измерения молярной массы являются г/моль и кг/моль.
Вещество может быть также охарактеризовано относительной молекулярной массой, равной массе молекулы или иной структурной единицы вещества, отнесенной к 1/12 массы одного атома изотопа углерода 12С (обозначение Mr(B)). Относительная молекулярная масса является величиной безразмерной. Относительные молекулярные массы элементов, называемые обычно относительными атомными массами (Аr(B)), приведены в ПСЭМ. Относительные атомные массы наиболее употребительных элементов необходимо запомнить (табл. 1.2).
Молярная масса вещества В (символ MB , единица – кг/моль) – это масса вещества В (mB), деленная на количество вещества nB,или это масса 1 моль вещества (6,02.1023 формульных единиц вещества (атомов, молекул, ионов, электронов и т.д.)). Молярная масса вещества (МВ) численно равна относительной молекулярной массе, например: относительная молекулярная масса натрия Mr(Na)=22,98977, а молярная масса натрия равна МNa=22,98977 г/моль. Относительные атомные массы элементов используют для вычисления молярных масс соединений.
Таблица 1.2. Округленные значения относительных атомных масс некоторых элементов
| Элемент | Элемент | ||||
| Русское название | Сим- вол | Относительная атомная масса | Русское название | Сим- вол | Относительная атомная масса |
| Водород | Н | Фосфор | P | ||
| Углерод | С | Сера | S | ||
| Азот | N | Хлор | Cl | 35,5 | |
| Кислород | O | Калий | K | ||
| Натрий | Na | Кальций | Ca | ||
| Магний | Mg | Железо | Fe | ||
| Алюмний | Al | Медь | Cu | ||
| Кремний | Si | Цинк | Zn |
Пример 1.1. Найти молярную массу серной кислоты (H2SO4).
Решение. Молярная масса серной кислоты численно равна сумме двух относительных атомных масс водорода, одной относительной атомной массы серы и четырех относительных атомных масс кислорода и измеряется в граммах на моль (г/моль):
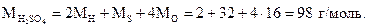
Количество вещества равно отношению массы вещества, выраженной в граммах или килограммах, к молярной массе вещества:
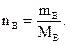 (1.1)
(1.1)
Пример 1.2. Найти количество вещества серной кислоты, если масса серной кислоты составляет 500 г.
Решение.
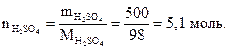
Согласно закону Авогадро в равных объемах любых газов при одинаковых давлении и температуре содержится одинаковое число молекул.Из закона Авогадро следует, что при температуре 273,15 К (0 оС) и давлении 101325 Па (нормальные условия, н.у.) 1 моль любого газа занимает объем 22,4 дм3 (л). Эта величина носит название молярный объем (VB).Объем газа, находящегося при произвольных условиях, может быть приведен к нормальным условиям с использованием формулы Менделеева–Клапейрона
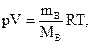 (1.2)
(1.2)
где р – давление газа; V – объем газа; mB – масса газа; МВ – молярная масса газа; Т – температура в градусах термодинамической шкалы Кельвина (К); R – универсальная газовая постоянная, равная 8,314 Дж/(моль•К), или (л•кПа)/(моль•К) в СИ, или 0,08206 (л•атм)/(моль•К), если давление выражено в атмосферах, или 62,36 (л•мм рт. ст.)/(моль•К), если давление выражено в мм ртутного столба.
При решении задач возможно использование округлённых значений температуры 273 К и давления 105 Па, соответствующих нормальным условиям, а также значения универсальной газовой постоянной 8,3Дж/(моль•К),
Пример 1.3. Найти количество вещества углекислого газа, если его объем при нормальных условиях составляет 5 дм3.
Решение. Составим пропорцию:
1 моль газа занимает объем 22,4 л,
х моль газа занимает объем 5 л.
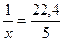 ;
; 

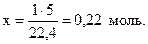
Постоянная Авогадро может быть использована для нахождения числа формульных единиц вещества*, числа атомов и т.п.
Пример 1.4. Найти число формульных единиц серной кислоты, число атомов водорода, серы и кислорода, содержащихся в 1000 г H2SO4.
Решение. Найдем количество вещества серной кислоты, используя формулу (1.1):
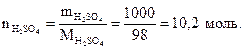
Составим пропорцию:
1 моль кислоты содержит 6,02.1023 формульных единиц H2SO4,
10,2 моль - “ - - “- х - “- - “- .
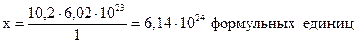 H2SO4.
H2SO4.

* Термин «формульная единица» может быть использован в тех случаях, когда термин «молекула» не соответствует реальным структурным единицам вещества. Так, в кристаллическом хлориде натрия невозможно выделить отдельные молекулы NaCl. Поэтому вместо термина «молекула NaCl» правильнее использовать термин «формульная единица NaCl» как отражающий состав соединения. Это применимо и к серной кислоте.
Одна формульная единица серной кислоты содержит 2 атома водорода, следовательно, 1000 г, или 10,2 моль, серной кислоты содержат 2•6,14.1024=1,228•1025 атомов водорода. Соответственно число атомов серы и кислорода составит 1•6,14•1024=6,14.1024 атомов серы и 4•6,14•1024=2,456•1025 атомов кислорода.
Химические формулы
Химические формулы выражают количественный и качественный состав соединения и одновременно обозначают массу, соответствующую 1 моль вещества. Например, формула азотной кислоты HNO3 означает: 1) это вещество образовано 1 атомом водорода, 1 атомом азота и 3 атомами кислорода или одним ионом водорода (Н+) и одним нитрат-ионом ( 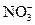 ); 2) на 1 массовую часть водорода в азотной кислоте приходится 14 массовых частей азота и 48 массовых частей кислорода; 3) масса 1 моль азотной кислоты равна 63г; 4) количество вещества азотной кислоты равно 1 моль; 5) 6,02•1023 формульных единиц азотной кислоты содержится в 1 моль этого вещества. Химические формулы используются для разнообразных расчётов.
); 2) на 1 массовую часть водорода в азотной кислоте приходится 14 массовых частей азота и 48 массовых частей кислорода; 3) масса 1 моль азотной кислоты равна 63г; 4) количество вещества азотной кислоты равно 1 моль; 5) 6,02•1023 формульных единиц азотной кислоты содержится в 1 моль этого вещества. Химические формулы используются для разнообразных расчётов.
Пример 1.5. Найти процентное содержание кальция, водорода и кислорода в гидроксиде кальция Са(OН)2.
Решение. Найдем молярную массу гидроксида кальция. Для этого в таблице ПСЭМ найдем относительные атомные массы кальция, кислорода и водорода и подставим их в формулу:
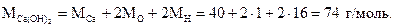 Можно также воспользоваться более удобной формулой:
Можно также воспользоваться более удобной формулой:
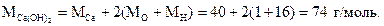
Для нахождения процентного содержания кальция составим пропорцию:
74 г Са(OН)2 содержат 40 г кальция,
100 г - “ - - “ - х г - “ – .
Следовательно, процентное содержание кальция в Са(OН)2 составит:
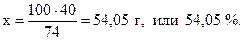
Аналогично находим процентное содержание водорода и кислорода:
74 г Са(OН)2 содержат 2 г водорода,
100 г - “ - - “ - х г - “ – ,
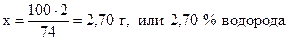 ;
;
74 г Са(OН)2 содержат 32 г кислорода,
100 г - “ - - “ - х г - “ – ,
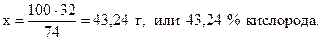
Проверим правильность вычислений. Суммарное содержание всех трех элементов в гидроксиде кальция составляет:
54,05+2,70+43,24=99,99 %.
Отклонение полученной величины от 100 % на 0,01% связано с округлением результатов.
Пример 1.6. Найти массу одной формульной единицы (молекулы) хлорида натрия (поваренной соли).
Решение.
1 моль NaCl содержит 6,02•1023 формульных единиц (молекул). Молярная масса хлорида натрия составляет
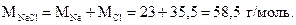
Составим пропорцию:
масса 6,02•1023 молекул NaCl составляет 58,5 г,
масса 1 - “ - - “ - - “ - - “ - х г,
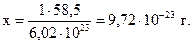
Пример 1.7.Найти простейшую формулу соединения, содержащего (по массе) 40 % углерода, 6,7 % водорода, 53,3 % кислорода, если плотность его паров по водороду составляет 15.
Решение. Обозначим числа атомов углерода, водорода и кислорода в простейшей формуле соединения через x, y и z. Молекулярные массы этих элементов равны 12, 1 и 16. Поэтому массы углерода, водорода и кислорода в составе соединения относятся как 12x:1y:16z. По условиям задачи это отношение равно 40:6,7:53,3. Следовательно,
12x:y:16z=40:6,7:53,3,
откуда 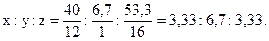
Чтобы выразить полученное отношение целыми числами, разделим его члены на меньшее из них:
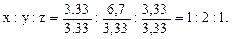
Таким образом, простейшая формула соединения – СН2О. Относительная молекулярная масса соединения Мr=12+2+16=30. Относительная молекулярная масса, определенная по относительной плотности, составляет
М = 2.15=30.
Следовательно, простейшая и истинная формулы соединения совпадают.
Отметим, что простейшие и истинные формулы веществ совпадают далеко не всегда. Например, простейшая формула глюкозы имеет вид СН2О, а истинная – С6Н12О6. Следовательно, простейшая формула отражает только соотношение числа атомов элементов в молекуле (формульной единице), но не число этих атомов в молекуле. Для определения истинной формулы помимо простейшей формулы обязательно определение молярной массы соединения.
Химические уравнения
Химические уравнения показывают вещества, вступающие в химическую реакцию, и образующиеся в результате продукты, а также количественные отношения между всеми участниками реакции. Например, уравнение
2HCl + Ca(OH)2 = CaCl2 + 2H2O
означает, что в реакцию вступают 2 моль соляной кислоты и 1 моль гидроксида кальция; образуются 1 моль хлорида кальция и 2 моль воды, а массы исходных веществ и продуктов реакции удовлетворяют соотношению
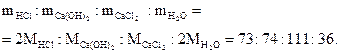
Пример 1.8. Серная кислота (H2SO4) реагирует с гидроксидом калия по уравнению
H2SO4 + 2KOH = K2SO4 + 2H2O.
Найти массу гидроксида калия, необходимую для реакции с 20 г серной кислоты, и массы сульфата калия и воды, образующиеся в результате реакции.
Решение. Молярные массы участников реакции составляют соответственно 98 (H2SO4); 56 (KOH); 176 (K2SO4) и 8 (H2O) г/моль. Из уравнения реакции следует, что 1 моль серной кислоты реагирует с 2 моль гидроксида калия или 98 г H2SO4 взаимодействуют с 2•56=112 г KOH. Составим пропорцию:
98 г H2SO4 реагируют со 112 г КОН,
20 г - “ - - “ - х г - “ - ,
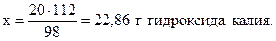
Аналогично в соответствии с уравнением реакции запишем:
из 98 г H2SO4 образуется 176 г K2SO4 ,
из 20 г - “ - - “ - х г - “ - ,
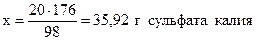 ;
;
из 98 г H2SO4 образуется 36 г Н2O,
из 20 г - “ - - “ - х г - “ – ,
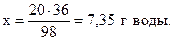
Пример 1.9. При взаимодействии серной кислоты и карбоната натрия выделилось 5,0 л углекислого газа (н.у.). Найти массы серной кислоты и карбоната натрия, взятые для реакции, а также массу сульфата натрия и воды, образовавшихся в результате реакции.
Решение. Запишем уравнение реакции:
H2SO4 + Na2CO3 = Na2SO4 + CO2 + H2O.
Из уравнения реакции следует, что в реакцию вступают 1 моль серной кислоты и 1 моль карбоната натрия и образуются по 1 моль сульфата натрия, углекислого газа и воды. Иначе говоря, в реакцию вступают 98 г H2SO4 и 106 г Na2CO3, а образуются 142 г Na2SO4, 44 г CO2 и 18 г H2O. 1 моль углекислого газа, или 44 г, занимает при нормальных условиях объем, равный 22, 4 дм3 (л).
Молярные массы участников реакции составят:
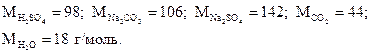
Из уравнения реакции следует:
для получения 22,4 л CO2 необходимо взять 98 г H2SO4,
- “ - - “ - 5 л - “ - - “ - х г - “ - ,
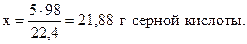
Количество углекислого газа можно выразить в граммах:
масса 22,4 л CO2 составляет 44 г,
- “ - 5 л - “ - - “ - х г,
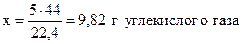 ,
,
и при последующих вычислениях использовать массу газа, а не объём.
Основываясь на уравнении реакции, найдём массы Na2CO3, Na2SO4 и H2O.
Для получения 44 г CO2 необходимо взять 106 г Na2CO3,
- “ - - “ - 9,82 г - “ - - “ - х г - “ – ,

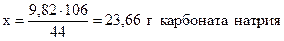 ;
;
при получении 44 г CO2 образуется 142 г Na2SO4,
- “ - - “ - 9,82 г - “ - - “ - х г - “ – ,

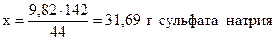 ;
;
при получении 44 г CO2 образуется 18 г H2O,
- “ - - “ - 9,82 г - “ - - “ - х г - “ –,
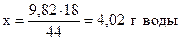 .
.
Контрольные задачи
1. Найдите количество вещества азотной кислоты, если её масса составляет 100 г.
Ответ: 1,59 моль.
2. Найдите количество вещества азота, если его объем при нормальных условиях составляет 15 дм3.
Ответ: 0,67 моль.
3. Найдите число формульных единиц гидрокарбоната кальция, число атомов кальция, водорода, углерода и кислорода, содержащихся в 300 г Ca(HCO3)2.
Ответ: 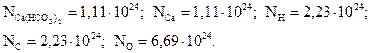
4. Найдите процентное содержание магния, азота и кислорода в нитрате магния Mg(NO3)2.
Ответ: ωMg=16,2; ωN=18,9;ωО=64,9 %.
5.Найдите массу одной молекулы хлора.
Ответ:1,18.10-22г.
6. Найдите массу гидроксида кальция, необходимую для реакции с 10 г хлороводорода, и массы хлорида кальция и воды, образующиеся в результате реакции
2HCl + Ca(OH)2 = CaCl2 + 2H2O.
Ответ: 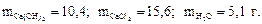
7. Найдите массы оксида кальция, воды и объем углекислого газа, образующиеся при термическом разложении 200 г гидрокарбоната кальция по реакции
Сa(HCO3)2=CaO+H2O+2 CO2.
Ответ: 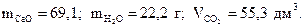
8. Найдите массы карбоната натрия и хлорида кальция, необходимые для получения 10 г карбоната кальция по реакции
Na2CO3 + СаCl2 = СаCO3↓ + 2NaCl.
Ответ: 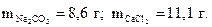
9. Найдите объём газообразного аммиака (н.у.) и массу серной кислоты, необходимые для получения 50 г сульфата аммония по реакции 2NH3 + H2SO4 =( NH4 )2SO4.
Ответ: 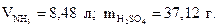
Строение атома
Атом состоит из ядра и электронной оболочки. Ядро состоит из заряженных протонов и незаряженных нейтронов. Число протонов равно порядковому номеру элемента в ПСЭМ. Например, порядковый номер кальция в ПСЭМ равен 20, следовательно, ядро кальция содержит 20 протонов. Число нейтронов определяется как разность между атомной массой изотопа элемента и его порядковым номером. Например, порядковый номер углерода в ПСЭМ равен 6, следовательно, ядро изотопа углерода 12С содержит 12 – 6 = 6 нейтронов, а изотоп углерода 14С содержит 14 – 6 = 8 нейтронов. Атомные массы элементов, приведенные в ПСЭМ, представляют собой средние атомные массы природной смеси различных изотопов элементов, поэтому эти величины не всегда могут быть использованы для нахождения числа нейтронов в ядре атома.
Заряд протона принято считать положительным. Он численно равен заряду электрона, который принято считать отрицательным. Атомы элементов электронейтральны, следовательно, число электронов в атоме равно числу протонов в ядре и равно порядковому номеру элемента в ПСЭМ.
Электроны в атоме образуют электронные уровни и подуровни. Число электронных уровней атома равно номеру периода в ПСЭМ, в котором располагается элемент. Например, элемент калий находится в четвертом периоде, следовательно, его электроны располагаются на 4 электронных уровнях. Электронные уровни могут быть обозначены целыми положительными числами от 1 до 7, что соответствует числу периодов в ПСЭМ. Эти числа носят название главного квантового числа, которое обозначается буквой n. В пределах электронного уровня электроны располагаются на электронных подуровнях. Максимально возможное число электронных подуровней на данном электронном уровне равно номеру уровня, однако в действительности число электронных уровней не превышает четырёх. Например, на 3-м электронном уровне может быть 3 электронных подуровня, а на 5-м и 6-м уровнях имеется только по 4 подуровня. Электронные подуровни обозначаются буквами латинского алфавита s,p,d,f и носят название орбитального или побочного квантового числа. На 1-м электронном уровне имеется только один электронный подуровень – s. Это записывается как 1s. На втором электронном уровне находятся 2 электронных подуровня s и p. Эти подуровни обозначаются как 2s и 2p. Соответственно на 3-м электронном уровне электроны располагаются на трёх подуровнях – 3s, 3p и 3d, а на 4-м – на четырёх подуровнях – 4s, 4p, 4d и 4f. Максимальное количество электронов на s-подуровне составляет 2, на p-подуровне – 6, на d-подуровне – 10, а на f-подуровне – 14. Количество электронов, находящихся на электронном подуровне, обозначается правым верхним индексом. Например, если на р-подуровне 2-го электронного уровня находятся 3 электрона, то это записывается как 2p3, а 7 электронов на d-подуровне 3-го электронного уровня обозначаются как 3d7.
Если на электронном уровне находятся несколько подуровней, то электроны в первую очередь заполняют s-подуровень, затем – p-подуровень, далее – d-подуровень и в последнюю очередь – f-подуровень. Распределение электронов по энергетическим уровням и подуровням называется электронной формулой элемента.
Пример 1.10. Записать электронную формулу атома элемента хлор.
Решение. Порядковый номер хлора в ПСЭМ равен 17, следовательно, ядро атома хлора содержит 17 протонов и нейтральный атом имеет 17 электронов. Хлор находится в 3-м периоде ПСЭМ, следовательно, электроны расположены на трех электронных уровнях. На 1-м уровне имеется только один электронный подуровень s, на котором могут находиться максимально 2 электрона (1s2). На 2-м уровне имеются 2 подуровня – s и p, на которых могут располагаться максимально 2 и 6 электронов, (соответственно (2s2 и 2p6)). На 3-м уровне могут быть 3 подуровня – s, p и d. Но на этом уровне у атома хлора находятся только 17-(2+2+6)=7 электронов. Два из них находятся на s- подуровне(3s2) и 5 – на p-подуровне (3p5). Таким образом, электронная формула хлора будет иметь вид 1s22s22p63s23p5.
Электронные формулы первых 20 элементов ПСЭМ приведены в табл. 1.3.
Отметим, что изложенное применимо в полной мере только к элементам первых трёх периодов ПСЭМ.
Периодическая система
Периодический закон Д.И. Менделеева формулируется так: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
Таблица периодического закона (табл.1.4) состоит из 8 вертикальных колонок, называемых группами, и 7 горизон-
тальных строк, называемых периодами. Группы состоят из 2
подгрупп, называемых главными и побочными. Главные подгруппы начинаются с элементов 1-го или 2-го периода
(водорода, гелия, лития, бериллия, бора, углерода, азота, кислорода, фтора),а побочные – с элементов 4-го периода (скандия,
Таблица 1.3.Электронные формулы элементов ПСЭМ
| Пери-од | Порядко-вый номер | Элемент | Электронная конфигурация | |
| Сим- вол | Название | |||
| H He | Водород Гелий | 1s1 1s2 | ||
| Li Be B С N O F Ne | Литий Бериллий Бор Углерод Азот Кислород Фтор Неон | 1s22s1 1s22s2 1s22s22p1 1s22s22p2 1s22s22p3 1s22s22p4 1s22s22p5 1s22s22p6 | ||
| Na Mg Al Si P S Cl Ar | Натрий Магний Алюминий Кремний Фосфор Сера Хлор Аргон | 1s22s22p63s1 1s22s22p63s2 1s22s22p63s23p1 1s22s22p63s23p2 1s22s22p63s23p3 1s22s22p63s23p4 1s22s22p63s23p5 1s22s22p63s23p6 | ||
| K Ca | Калий Кальций | 1s22s22p63s23p34s1 1s22s22p63s23p34s2 |
титана, ванадия, хрома, марганца, железа, кобальта, никеля, меди и цинка). Периоды делятся на малые (1,2 и 3-й) и боль- шие (4,5,6 и 7-й). Малые периоды состоят из одного ряда,а большие – из двух рядов. Кроме того, две группы элементов (лантаниды и актиниды) располагаются отдельно, в нижней части таблицы.
Элементы, находящиеся в одной группе и одной подгруппе, обладают большим сходством химических свойств.
Это связано с тем, что химические свойства элементов определяются в значительной степени числом электронов на внешней электронной оболочке, а элементы из одной группы и подгруппы имеют одинаковое число электронов на внешней электронной оболочке и аналогичное строение этой оболочки.
Таблица 1.4.Периодическая система элементов Д.И. Менделеева
| Периоды | Ряды | Группы элементов | |||||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||||
| I | H | He | |||||||||||
| II | Li | Be | B | С | N | O | F | Ne | |||||
| III | Na | Mg | Al | Si | P | S | Cl | Ar | |||||
| IV | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | |||
| V | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||
| VI | 37 Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | |||
| VII | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||
| VIII | Cs | Ba | 57* La | Hf | Ta | W | Re | Os | Ir | Pt | |||
| IX | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| X | Fr | Ra | 89* Ac | Ku | Ns | Sg | Bh | Hs | Mt | Ds | |||
* Л А Н Т А Н И Д Ы
| 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu |
| **А КТ И Н И Д Ы |
| 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 (No) | 103 (Lr) |
Например, азот и фосфор находятся в главной подгруппе 5-й группы. На внешней оболочке каждого из этих элементов находится по 5 электронов, а строение внешних оболочек выражается формулами 2s22p3 (N) и 3s23p2 (Р). Число электронов на внешней электронной оболочке определяет способность атома образовывать соединения с другими атомами посредством химических связей. Один электрон на внешней оболочке может обычно образовывать одну химическую связь. Так, азот и фосфор могут образовывать 5 связей, а литий и натрий, у которых на внешней оболочке находится только по одному электрону (2s1 – Li и 3s1 – Na), образуют по одной связи. Атом химического элементаможет образовывать или постоянное, или переменное число связей. Например, кальций всегда образует только 2 связи, а азот может образовывать 1, 2, 3, 4 или 5 связей. Образование химических связей может сопровождаться потерей электронов атомом. В этом случае говорят, что атом проявляет положительную степень окисления (СО). Примерами могут быть литий, натрий, калий, магний, кальций. Эти элементы в химических реакциях всегда отдают электроны, т.е. проявляют положительные СО. Атомы ряда элементов, напротив, в химических реакциях принимают электроны и проявляют отрицательные СО.Примерами могут быть кислород и фтор. Очень многие элементы, в зависимости от конкретной реакции, могут как отдавать, так и принимать электроны.
Часть элементов могут проявлять только одну СО, равную номеру группы. Эта СО называется высшей СО элемента. К таким элементам относятся, например, литий, натрий, магний, кальций, алюминий. Другие элементы помимо высшей СО могут проявлять и другие, низшие, СО. Например, фосфор может проявлять СО +5 и +3, а сера – +6 и +4.
Исключениями из элементов главных подгрупп являются фтор, который проявляет только СО, равную -1, а также гелий, неон и аргон, которые химических соединений не образуют, т.е. их СО равна нулю.
Степень окисления является важнейшим свойством элемента, определяющим его химические свойства. Основные СО ряда элементов ПСЭМ приведены в табл. 1.5.
Степень окисления элемента может быть использована для составления формулы химического соединения.
Таблица 1.5. Основные степени окисления некоторых элементов ПСЭМ
| Пе- риод | Группы | |||||||
| H +1; -1 | He | |||||||
| Li +1 | Be +2 | B +3 | C +(2,4) -4 | N +(1,2,3,4,5) -3 | O -2 | F -1 | Ne | |
| Na +1 | Mg +2 | Al +3 | Si | P 3,5 | S +(2,4,6) -2 | Cl +(1,3,5,7) -1 | Ar | |
| K +1 | Ca +2 |
Пример 1.11. Составить формулы соединений с кислородом натрия, магния, алюминия, кремния, фосфора, серы и хлора в высших степенях окисления.
Решение. Сумма СО элементов в соединении, состоящем из двух элементов (бинарное соединение), должна быть равна нулю. Следовательно, формула оксида натрия будет иметь вид Na2O, т.е. сумма СО атома кислорода (-2) и сумма СО двух атомов натрия [2(+1)=+2] будет равна нулю. Аналогично получим формулы оксидов других элементов: MgO; Al2O3; SiO2; P2O5; SO3; Cl2O7.
Очевидно, что все элементы, находящиеся в одной и той же подгруппе, будут иметь аналогичные формулы высших оксидов, например, элементы 5-й группы главной подгруппы (азот, мышьяк, сурьма и висмут) будут иметь высшие оксиды состава N2O5, As2O5, Sb2O5, Bi2O5.
1.8. Контрольные вопросы и задачи
1. Сколько протонов, нейтронов и электронов содержит атом изотопа 25Mg? Ответ: 12, 13, 12.
2. Какие из следующих элементов на внешнем уровне имеют 2 р-электрона ( натрий, углерод, фосфор, сера, кальций, кремний) ?
Ответ: углерод, кремний.
3. Запишите электронную формулу элемента, имеющего в ПСЭМ порядковый номер 15.
Ответ: 1s22s22p63s23p3.
4. Составьте формулу соединения мышьяка с серой, если СО мышьяка равна +5, а серы – - 2.
Ответ: As2 S5.
5. Найдите СО серы в соединении Al2S3.
Ответ: -2.
