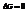Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений.
В настоящее время невозможно рассчитать или экспериментально определить абсолютное значение потенциала на отдельно взятом электроде (абсолютный электродный потенциал).
Поэтому значение потенциала на электроде всегда определяется по отношению к эталонному электроду, потенциал которого условно принимается за нуль.
В электрохимии таким электродом является нормальный водородный элемент.
Его устройство: в стеклянный сосуд сложной формы залит раствор серной кислоты такой концентрации, что 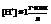 В него опущена платиновая пластинка, покрытая платиновой чернью. Снизу в сосуд подается газообразный водород. Насыщенная им пластина ведет себя как водородный электрод. То есть имеет место равновесие: (губчатая пластина) – платиновый электрод, Р=1атм. Водород омывает платину, растворяется в ней. Насыщенная водородом платина начинает вести себя как водородный электрод, т.е.
В него опущена платиновая пластинка, покрытая платиновой чернью. Снизу в сосуд подается газообразный водород. Насыщенная им пластина ведет себя как водородный электрод. То есть имеет место равновесие: (губчатая пластина) – платиновый электрод, Р=1атм. Водород омывает платину, растворяется в ней. Насыщенная водородом платина начинает вести себя как водородный электрод, т.е. 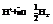
Скачок потенциала на границе 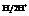 имеет определенную величину, которую принимают за 0.
имеет определенную величину, которую принимают за 0.
За условную величину, характеризующую потенциал электрода, принимают ЭДС гальванического элемента, составленного из этого электрода и НВЭ.
Стандартный потенциал металла – ЭДС гальванического элемента, состоящего из данного электрода, погруженного в раствор, где активность ионов металла равна 1, и из СВЭ.
Уравнение Нернста (T=298К): 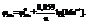 Если расположить все металлы в ряд по алгебраической величине их стандартных потенциалов, получим ряд напряжений.
Если расположить все металлы в ряд по алгебраической величине их стандартных потенциалов, получим ряд напряжений.
Отрицательный потенциал принадлежит электродам, которые заряжаются отрицательно по отношению к НВЭ.
Положительный – электрод заряжается положительно по отношению к НВЭ.
Зависимость ЭДС гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная ЭДС.
Гальванический элемент – любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.
Влияние природы реагирующих веществ.
Пусть протекает реакция: 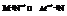 Максимальная полезная работа:
Максимальная полезная работа: 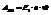
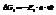
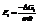
Реакция2: 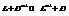
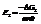
Вывод. В зависимости от природы веществ, ЭДС будет меняться.
Влияние температуры.
Согласно уравнению Гиббса-Гельмгольца, работа реакции. При наличии исходных термохимических данных можно рассчитать ЭДС. 2)Зависимость от температуры: 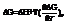
Сделаем подстановки: 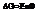
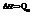
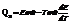
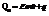
Qp – теплота реакции, которая выделяется или поглощается при ее необратимом проведении. Если реакция протекает обратимо, то часть энергии реакции превращается в работу А, а часть q остается в виде теплоты в элементе, q характеризует связанную энергию.
Определив градиент ЭДС, можно вычислить изменение энтропии для реакции.
Если q<0, 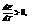 т.е. ЭДС уменьшается с ростом температуры.
т.е. ЭДС уменьшается с ростом температуры.
Если q>0, 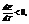 т.е. ЭДС растет с ростом температуры.
т.е. ЭДС растет с ростом температуры.
Для гальванических элементов q подбирают малом, чтобы 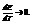
Влияние концентрации.
Пусть реакция 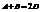
Изотерма реакции: 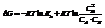
Преобразуем и получим: 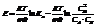
Обозначим первое слагаемое за 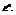
Это стандартная ЭДС, она отвечает случаю равенства единице концентраций всех участвующих веществ, т.е. стандартному изменению свободной энергии реакции