Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
Существует несколько формулировок:
Невозможен самопроизвольный переход тепла от менее нагретого тела более нагретому.
Невозможно создание вечного двигателя второго рода (машины, которая периодически превращает тепло среды при постоянной температуре в работу.
Термодинамический КПД: 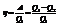
____________________
Для изолированных систем критерием, позволяющим судить о направлении процессов и об условиях равновесия, является функция – S-энтропия.
Процессы протекают в сторону увеличения энтропии. При равновесии энтропия достигает максимума. Обратное протекание процессов не может быть самопроизвольным – требуется затрата работы извне.
Физический смысл функции состояния энтропии легче всего проиллюстрировать на примере кипения жидкости.
При нагреве Т и U увеличивается до тех пор, пока жидкость не закипит. При этом поглощается теплота испарения, затрачиваемая на увеличение беспорядка в системе.
Таким образом, энтропия – мера упорядоченности состояния системы. 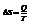 - второе начало термодинами для обратимых процессов.
- второе начало термодинами для обратимых процессов.
В изолированной системе процессы самопроизвольные процессы протекают в сторону увеличения энтропии 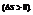 В неизолированных – возможно
В неизолированных – возможно 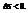
Примеры:
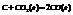
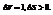
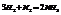
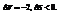
22. Объединенная формула первого и второго закона термодинамики. Свободная энергия Гиббса и Гельмгольца.
Первый закон.
Теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.
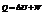
Второй закон.
Несколько формулировок, выберем эту: в изолированных системах самопроивзольно идут процессы, которые сопровождаются возрастанием энтропии: 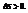
Энтропия – термодинамическая функция, характеризующая меру неупорядоченности состояния системы. Она используется для суждения о направлении самопроизвольно протекающих процессах.
Обобщенный закон.
Для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает.
Энергия Гельмгольца.
Максимальная работа, которую может совершить система при рановесном проведении процесса, равна изменению энергии Гельмгольца реакции 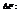
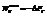
Энергия Гельмгольца равна 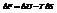
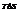 называют связанной энергией.
называют связанной энергией.
Она характеризует предел самопроизвольного течения реакции, которое возможно при 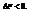
Энергия Гиббса.
Энтальпийный и энтропийный факторы, характеризующие процессы, объединены функцией - энергия Гиббса.
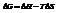 Поскольку энергию Гиббса можно превратить в работу, то ее называют свободной энергией.
Поскольку энергию Гиббса можно превратить в работу, то ее называют свободной энергией. 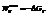
Химическая реакция возможна, если энергия Гиббса уменьшается (<0).
Энергия Гиббса образования вещества – изменение энергии Гиббса системы при образовании 1 моль вещества В из простых веществ, устойчивых при 298 К.
