На нейтрализацию 2,45 г. кислоты расходуется 2,80 г. гидроксида калия. Определить
На степень электролитической диссоциации не оказывает влияние:давление; 2cl
Название какой соли составлено неверно:гидрохлорид железа (II);
Наиболее ярко выражены восстановительные свойствау иодида;
Наиболее ярко выражены окислительные свойствау фтора
Найти массу изотопа 81Sr (Т1/2 = 8,5 ч), оставшуюся через 25,5 часов хранения, если первоначальная масса его составляла 200 мг:25 мг
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Al1→ AlCl3 2→ Al(OH)3 3→ Al2(SO4)3 4→ Al(OH)3 В ответе укажите число молей воды, получающихся по реакции нейтрализации.6 моль;
Напишите формулу высшего оксида мышьяка. В ответе укажите сумму индексов в этой формуле.7;
Напишите формулу гидроксида железа (III). В ответе укажите молярную массу вещества.107 г/моль;
Напишите формулу нитрата алюминия. В ответе укажите молярную массу вещества.213 г/моль;
Напишите формулу ортофосфата кальция. В ответе укажите молекулярную массу вещества.310 г/моль;
Напишите формулу сульфата натрия. В ответе укажите молярную массу вещества.142г/моль;
Напишите, какая группа веществ реагирует с разбавленной серной кислотой?Cu(OH)2, Mg, BaCl2;
О
О фторе нельзя сказать, что онсамый легкий элемент
Объем занимаемый 10 г кислорода больше объема, занимаемого 10 г оксида серы (IV) при нормальных условиях, в …2 раза.
Объем занимаемый 6 г водорода, больше объема занимаемого 6 г метана при нормальных условиях, в…7 раз
Один из механизмов образования ковалентной связи:обменный;
Одноосновная кислота:уксусная;
Одноосновной кислотой является:синильная.
Окислители – это:Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции понижается
Оксид, взаимодействующий как с кислотой, так и с основанием, относится к…амфотерным оксидам;
Определите значение рН водного раствора, если концентрация ионов гидроксида равна 10-11 моль/л:3;
Определите значение рН водного раствора, если концентрация ионов гидроксида 10-2
Определите массовую долю сурьмы в оксиде сурьмы (III) Sb2O3 составляет…83,6 %
Определите молярную массу эквивалента (г/моль) серы в оксиде серы (VI):5,3
Определить относительную молекулярную массу газа, если его плотность по воздуху равна 5,5.159,5.
Определить относительную молекулярную массу газа, если его плотность по кислороду равна 1,375.44
Определить относительную молекулярную массу газа, если его плотность по метану равна 1,06.17;
Определить относительную молекулярную массу газа, если его плотность по водороду равна 17.34
Определить относительную молекулярную массу газа, если его плотность по азоту равна 1,21.34;
Определить скорость химической реакции, если через10 минут после начала реакции концентрация продукта реакции увеличилась на 3,5 моль/л0,35моль/л ∙ мин
Основание массой 1,85 г взаимодействует с серной кислотой массой 2,45 г с образованием средней соли. Молярная масса эквивалента основания:37 г/моль
Основание массой 2,45 г взаимодействует с серной кислотой массой 2,45 г с образованием средней соли. Молярная масса эквивалента основания:49 г/моль
Основание массой 8,55 г взаимодействует с серной кислотой массой 4,9 г с образованием средней соли. Молярная масса эквивалента основания:85,5 г/моль
Основной оксид:Na2O;
Основные свойства гидроксидов элементов JА группы по мере увеличения порядкового номеравозрастают,
Относительная плотность газа по воздуху равна 0,138. Определите относительную молекулярную массу газа:4
Отношение количества растворенного вещества к массе растворителя – это:моляльная концентрация
Отношение количества растворенного вещества к объему раствора – это:молярная концентрация
Отношение массы растворенного вещества к массе раствора – это:массовая доля растворенного вещества
П
Первая искусственная ядерная реакция, осуществленная в 1919 г. Резерфордом: 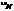 +
+ 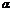 →
→ 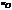 + ρ
+ ρ 
По методу МО в молекуле какого вещества имеются неспаренные электроны:O2
Подберите коэффициенты в уравнении V+HF+HNO3 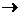 H2VF7+NO+H2O и укажите коэффициент при формуле воды:10;
H2VF7+NO+H2O и укажите коэффициент при формуле воды:10;
Правило Вант-Гоффа показывает зависимость скорости реакции от:температуры;
Правильное чтение величины Мэ:Молярная масса эквивалента
При 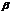 - - распаде ядро атома радиоактивного элемента испускает:электрон;
- - распаде ядро атома радиоактивного элемента испускает:электрон;
При 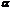 - распаде ядро атома радиоактивного элемента испускает:протона и два нейтрона, объединенные в ядро атома гелия;
- распаде ядро атома радиоактивного элемента испускает:протона и два нейтрона, объединенные в ядро атома гелия;
При 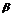 + - распаде ядро атома радиоактивного элемента испускает:позитрон
+ - распаде ядро атома радиоактивного элемента испускает:позитрон
При взаимодействии каких оксидов образуется сульфат калия?SO3, K2O;
При гидролизе какой соли в водном растворе рН<7:ZnCI2;
При измерении электродных потенциалов металлов в качестве электрода сравнения используется:водородный электрод;
При нормальных условиях 532,5 г хлора занимают объем равный:168 л
При отщеплении воды от одноосновной кислоты массой 16, 0 г, образованной элементом в степени окисления +5, получится оксид массой 14.56 г. Какая кислота была взята:метаванадиевая;
при повышении давления:Равновесие сместится в правую сторону;
При прокаливании на воздухе металла (III) массой 10, 8 г получен оксид металла массой 20, 4 г. Какой металл взят при прокаливании:алюминий AI;
При разбавлении серной кислоты всегда приливают кислоту к воде. Чем опасно разбавление концентрированной H2SO4 приливанием к ней воды:может произойти разбрызгивание раствора вследствие выделения теплоты;
при удалении из системы аммиака:Равновесие сместится в правую сторону
При электролизе водных растворов каких из солей на катоде выделяется водород:MqCl2
При электролизе водных растворов какой соли на катоде выделяется металл:CuSO4;
При электролизе раствора сульфата меди (II) на инертных электродах выделяются :Cu, O2;
Примером неполярной молекулы, имеющей полярную ковалентную связь, будет:CCl4
Природный магний состоит из изотопов 24 Мg, 25 Мg, 26 Мg. Вычислить среднюю атомную массу магния, содержание отдельных изотопов соответственно равно 78,6; 10,1; 11,3%: 24,32
Продуктами гидролиза AlCI3 по первой ступени являются:AIOHCI2 + HCI
Продуктами гидролиза К3РО4 по второй ступени являются:КН2РО4 и КОН
Простые вещества каких элементов обладают наибольшим сходством физических и химических свойств:F, CI;
Процесс диссоциации слабого электролита количественно характеризуется:константой диссоциации
Р
равно 8. Это соответствует содержанию:Принципа Паули;
Разложение по схеме 2КСlО3 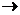 2КCl + О2 является реакцией:Внутримолекулярного окисления – восстановления;
2КCl + О2 является реакцией:Внутримолекулярного окисления – восстановления;
расставьте коэффициенты и укажите коэффициент перед восстановителем:3;
Расставьте коэффициенты в уравнении AI+NaOH+H2O 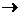 Na3[AI(OH)6]+H2 и подсчитайте их сумму:19
Na3[AI(OH)6]+H2 и подсчитайте их сумму:19
Раствор какого из приведенных соединений марганца имеет зеленую окраску :K2MnO4;
