Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
Многоэлектронные атомы. Последовательность энергетических уровней и подуровней. Правила Клечковского. Правило Гунда.
| Вид атома | Энергетические состояния |
| Атом H | 1s<2s=2p<3s=3p=3d<4s=4p=4d=4f<5s=5p=5d=5f |
| Многоэлектр атомы | 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d |
Электронный уровень – совокупность орбиталей с одинаковыми значениями главного квантового числа. Электронный подуровень – совокупность орбиталей одного уровня с одинаковыми значениями орбитального квантового числа.В атоме водорода электрон находится в силовом поле, которое создается только ядром. В много электронных атомах на каждый электрон действует не только ядро, но и все остальные электроны.В атоме водорода атомные орбитали (АО) на одном энергетическом уровне «вырождены», т.е. имеют одинаковые значения для всех подуровней. Во многоэлектронных атомах из-за действия сил межэлектронного отталкивания уровни энергии расширяются в энергетическую зону с энергетическими подуровнями, обозначаемыми s-, p-, d-, f- подуровни. В пределах одного электронного слоя электронные состояния - s, p, d, f - отличаются по энергиям, причем Es < Ep < Ed <Ef. Поскольку состояния s, p, d, f в многоэлектронных атомах имеют разную энергию, их называют энергетическими подуровнями. Заполнение электронами квантовых слоев и энергетических подуровней в реальных атомах происходит с соблюдением трех основных принципов.1.Принцип наименьшей энергии. Электроны занимают в атоме орбитали с наименьшей энергией. Последовательность расположения АО по уровням энергии при заполнении электронами определяется правилом Клечковского: электроны в невозбужденном атоме располагаются в состояниях, где меньше сумма (n+l), так как энергия электронов зависит от n и l и не зависит от ml и ms. При одинаковом значении этой суммы в первую очередь заполняется орбиталь с меньшим значением главного квантового числа (n). Последовательность заполнения электронами атомных орбиталей в порядке возрастания энергии представлена в таблице:
2 Правило Хунда. При заполнении ‘нергетического подуровня, электроны стремятся заполнить свободные орбитали, сначала по одному с параллельными спинами, а затем по второму с противоположными спинами.
Примеры: 

Образование кратных ковалентных связей. Их особенности. Делокализованные П-связи.
Встречающиеся в органических соединениях кратные связи (двойные или тройные):
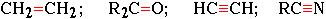
образуются при обобществлении двумя атомами более чем одной пары электронов:
Н2С : : СН2; R2С : : О; HС : : : CH; RС : : : N и т.д.
Кратные связи являются сочетанием σ- и π-связей.
Двойная связь состоит из одной σ- и одной π-связей и осуществляется 4-мя общими электронами.
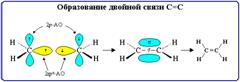
Тройная связь является комбинацией из одной σ- и двух π-связей и включает в себя шесть электронов.
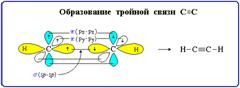
Число электронных пар, участвующих в образовании ковалентной связи называется порядком связи. Таким образом, порядок простой связи равен 1, двойной – 2, тройной – 3.
В случае сопряженных (делокализованных) связей порядок связи отличается от этих целочисленных значений.
Ковалентная связь считается локализованной, если её электронная пара находится в поле двух ядер и связывает только два атома. Делокализованная связь - связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов (подобие металлической связи). Такая делокализация (рассредоточение) электронов характерна для сопряженных π-связей, т.е. кратных связей, чередующихся с одинарными.
Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
Энергия АО – энергия электрона, находящегося на этой орбитали (то есть в этом состоянии). Квантовая ячейка – символическое изображение орбитали на энергетической диаграмме. Электронный уровень – совокупность орбиталей с одинаковыми значениями главного квантового числа. Электронный подуровень – совокупность орбиталей одного уровня с одинаковыми значениями орбитального квантового числа.Квадрат волновой функции ψ2 определяет плотность вероятности нахождения электрона в точке с координатами (x, y, z). ψ2·ΔV –вероятность нахождения электрона в данном объеме атома ΔV. Чем больше ψ2·ΔV, тем плотнее электронное облако в данном объеме атома. Каждой волновой функции соответствует набор из трех целочисленных параметров - квантовых чисел – n, l, ml. Область пространства, в которой вероятность нахождения электрона составляет не менее 90%, называют атомной орбиталью. Атомные орбитали различаются по энергии, размерам, форме, ориентации в пространстве и могут быть охарактеризованы квантовыми числами.Квантовые числа – это энергетические параметры, определяющие состояние е- и тип АО (атомн орбитали), на которой он находится.Главное квантовое число – n - принимает только целые положительные значения n = 1, 2, 3…∞. С увеличением n энергия и размер электронного облака (атомной орбитали) возрастает. Совокупность атомных орбиталей с одинаковым значением n называют уровнем, или электронным слоем. Максимально возможные числа орбиталей и электронов на уровне соответственно равны n2 и 2n2.Орбитальное квантовое число l определяет значения орбитального момента количества движения электрона и принимает значения от 0 до (n-1), например, при n = 3: l = 0, 1, 2. Характеризует форму атомных орбиталей (электронных облаков), для которых в зависимости от l приняты соответствующие обозначения: l 0, 1, 2, 3, 4, 5… обозначение s, p, d, f, g, h…s - Орбиталь (s – электронное облако) имеет шарообразную форму. При l=1 зона вероятностного распределения электронов представляет собой гантелеобразное облако с центром в ядре (р-орбиталь). У d - орбитали (l = 2) и f - орбитали (l= 3) форма электронных облаков еще более сложная. Совокупность атомных орбиталей с одинаковым значением n и l называют подуровнем или электронной подоболочкой. Число возможных орбиталей и электронов в пределах подуровня соответственно равны (2l+1) и 2(2l+1).Каждому значению  соответствует определённая форма орбитали (например, при
соответствует определённая форма орбитали (например, при 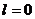 – это сфера, центр которой совпадает с ядром).
– это сфера, центр которой совпадает с ядром). 
Магнитное квантовое число ml может принимать положительные и отрицательные целочисленные значения от минус l до плюс l через нуль. В зависимости от значений ml определяются возможные ориентации орбиталей одной формы и их число, которое равно количеству значений ml. Так, для s - орбиталей (l = 0, ml = 0), возможна одна ориентация, поскольку шар симметричен относительно трех осей ординат. Для р - орбиталей (l=1, ml = -1, 0, +1), что соответствует трем ориентациям р - орбиталей относительно трех осей. Для d - орбиталей (l=2, ml = -2, -1, 0, +1, +2) число возможных ориентаций – пять, для f – орбиталей - семь.Спиновое (ms) квантовое число характеризует сложное движение электрона вокруг собственной оси и принимает значения +1/2 или –1/2.
Четыре квантовых числа n, l, ml и ms -полностю определяют состояние электрона в атоме
