Периодический закон Д.И. Менделеева. Структура Периодической системы. Связь Периодической системы со строением атома.
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. Периодическую систему химических элементов в настоящее время рассматривают как классификацию элементов в зависимости от зарядов ядра и от строения электронных оболочек невозбужденных атомов. Периодический закон: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов. Периодический закон основывается на современной теории строения атома: периодические изменения свойств элементов и их соединений происходят из-за периодически повторяющихся подобных структур электронных оболочек атомов.
Структура периодической системы Последовательность заполнения электронных оболочек атомов периодической системы выглядит следующим образом.
1. Начало нового электронного слоя соответствует началу нового периода. Число элементов в данном периоде определяется максимальным количеством электронов на заполняемых подуровнях. Каждый период заканчивается элементом, имеющим заполненный внешний p - подуровень (инертные газы).
2. Элементы, атомы которых имеют подобную электронную конфигурацию, являются электронными аналогами и образуют группу периодической системы. В короткопериодной таблице к главной подгруппе относятся элементы, у которых на стадии заполнения находятся s- и p- атомные орбитали (s- и p-элементы). К побочной подгруппе относятся элементы, у которых заполняются d-орбитали (d-элементы).
Химическая природа атома зависит от способности отдавать или принимать внешние и предвнешние электроны. Периодически изменяются такие свойства атомов: атомные и ионные радиусы, энергии (потенциалы) ионизации атомов, сродство к электрону, электроотрицательность (ЭО), валентность и т.д. От изменения этих свойств атомов (увеличения или уменьшения) зависят металлические (восстановительные) или неметаллические (окислительные) свойства атомов. Физической основой структуры периодической системы элементов служит определённая последовательность формирования электронных конфигураций атомов по мере роста порядкового номера элемента. Число протонов в ядре атома равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
6. Атомные и ионные радиусы, энергия ионизации, сродство к электрону, электроотрицательность; их связь с Периодической системой Д.И. Менделеева.
Зависимость атомных радиусов от заряда ядра атома Z имеет периодический характер. В пределах одного периода с увеличением Z уменьшаются размеры атома. Это объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда. С началом застройки нового электронного слоя, более удаленного от ядра, т.е. при переходе к следующему периоду, атомные радиусы возрастают. В результате в пределах подгруппы с возрастанием заряда ядра размеры атома увеличиваются.
В результате потери или присоединения атомом или молекулой одного или нескольких электронов образуется одноатомная или многоатомная заряженная частица -ион.
Потеря атомами электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению. Поэтому радиус катиона всегда меньше, а радиус аниона всегда больше радиуса соответствующего им электройнетрального атома.
 Пример: радиуса атома калия 0,236 нм, а радиус иона К+ 0,133 нм. Радиус иона тем сильней отличается от радиуса атома, чем больше заряд иона. В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Это объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра.
Пример: радиуса атома калия 0,236 нм, а радиус иона К+ 0,133 нм. Радиус иона тем сильней отличается от радиуса атома, чем больше заряд иона. В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Это объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра.
Для отрыва электрона от атома с превращением последнего в положительный ион нужно затратить некоторую энергию, называемую энергией ионизации. Выражается в эВ
При затрате достаточной энергии можно оторвать от атома два, три и более электронов. Поэтому говорят о первом потенциале ионизации (энергия отрыва первого электрона), втором потенциале ионизации (энергия отрыва второго электрона) и т.д. Последовательные потенциалы ионизации атома возрастают, т.к. по мере последовательного удаления электронов от атома положительный заряд образующегося иона возрастает, и следовательно требуется большая затрата энергии. Величина потенциала ионизации может служить мерой большей или меньшей «металличности» элемента: чем < потенциал ионизации, чем легче оторвать электрон от атома, тем сильнее должны быть выражены металлические свойства элемента. С увеличением порядкового номера элемента потенциалы ионизации уменьшаются, что свидетельствует об усилении металлических и соответственно ослаблении неметаллических свойств, эта закономерность связана с возрастанием радиусов атомов. Увеличение числа промежуточных электронных слоев между ядром атома и внешними электронами приводит к уменьшению его эффективного заряда – все это приводит к ослаблению связи внешних электронов с ядром и следовательно к уменьшению потенциала ионизации. У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают.
Энергия, выделяющаяся при присоединении электрона к свободному атому, называется сродством атома к электрону. Также выражается в эВ
Сродство к электрону атомов металлов, как правило, близко к нулю или отрицательно – из этого следует, что для атомов большинства металлов присоединение электронов энергетически невыгодно. Сродство же к электрону неметаллов всегда положительно и тем больше, чем ближе к благородному газу расположен неметалл в периодической системе; это свидетельствует об усилении неметаллических свойств по мере приближения к концу периода.
Электpоoтрицательность— способность атома удерживать внешние (валентные) электроны. Она определяется степенью притяжения этих электронов к положительно заряженному ядру. Это свойство проявляется в химических связях как смещение электронов связи в сторону более электроотрицательного атома. Электpоотрицательность атомов, участвующих в образовании химической связи, – один из главных факторов, который определяет не только ТИП, но и СВОЙСТВА этой связи, и тем самым влияет на характер взаимодействия между атомами при протекании химической реакции. Элeктроотрицательность элементов подчиняется периодическому закону: она растет слева направо в периодах и снизу вверх в главных подгруппах Периодической системы элементов Д.И. Менделеева. Электроотрицательность не является абсолютной константой элемента. Она зависит от эффективного заряда ядра атома, который может изменяться под влиянием соседних атомов или групп атомов, типа атомных орбиталей и характера их гибридизации.
7. Виды химической связи. Ковалентная связь. Механизмы её образования.
Под химической связью понимают силы притяжения, удерживающие атомы или (ионы) друг около друга и создающие тем самым достаточно стабильный агрегат атомов (или ионов). По современным представлениям, химическая связь имеет электростатическую природу. В ее образовании участвуют валентные электроны внешних и предвнешних подуровней атомов. Выделяют три основных типа химической связи: ковалентная, ионная, металлическая.
Для объяснения природы ковалентной связи и механизма ее образования используются два метода – метод валентных связей (ВС) и метод молекулярных орбиталей (МО). В основе метода ВС лежит теория Льюиса об образовании ковалентной связи формированием общей пары электронов между взаимодействующими атомами. В 1927 г. немецкие физики Гейтлер и Лондон провели квантово-механический расчет с использованием уравнения Шредингера для выяснения вопроса – как изменяется энергия в системе из двух атомов водорода при их сближении.
Из расчетов были получены следующие выводы: 1. Для образования химической связи атомы должны предоставить в общее пользование электроны с противоположными спинами. 2. Атомные орбитали при образовании химической связи «перекрываются». 3. При образовании химической связи выделяется энергия, называемая энергией связи, что является движущей силой протекания химической реакции.
Связь, образованную посредством перекрывания электронных облаков, то есть осуществляемую общей парой электронов с противоположными спинами, называют ковалентной связью. Если электронные облака перекрываются вдоль линии, соединяющей ядра атомов, образуется σ-связь. Если электронные облака перекрываются выше и ниже линии, соединяющей ядра атомов, образуется π-связь. σ-Связь более прочная, вокруг нее возможно вращение без ее разрыва. π-Связь менее прочная и образуется как дополнительная. Порядок (кратность) связи определяется числом общих электронных пар, осуществляющих связь между ядрами атомов.
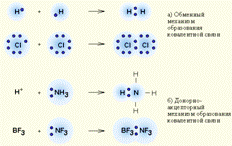
Общая пара связывающих электронов может образоваться в результате объединения взаимодействующими атомами неспаренных электронов с противоположными спинами (обменный механизм). Во многих случаях число связей, образованных атомом, оказывается больше числа неспаренных электронов в основном состоянии. Это объясняется возможностью образования связей из возбужденного состояния: происходит распаривание одной или нескольких внешних электронных пар с последующим переходом одного электрона от каждой пары на свободную орбиталь более высокого подуровня того же внешнего уровня. Энергия, затраченная на возбуждение атома, с большим избытком компенсируется энергией, выделяемой при образовании связей возбужденным атомом. Например, для бора характерно образование трех связей в соединениях (BF3) в результате перехода в возбужденное состояние с тремя неспаренными электронами: B …2s22p1 → B*…2s12p2.
Как правило, максимальная валентность элемента совпадает с номером группы, в которой он находится, исключение составляют N, O, F и некоторые d - металлы с почти заполненным предвнешним d - подуровнем.
Второй механизм образования ковалентной связи – донорно-акцепторный: один атом (донор) представляет неподеленную пару электронов, а другой (акцептор) свою вакантную орбиталь.