Вопрос: углерод, хим.св-ва; оксиды углерода,св-ва;соли угольн.к-ты;соединения углеррода с металлами и неметаллами.
Природн.углерод состоит из 2 стабильн.изотопов.Также получены радиоактивн.изотопы с b-излучением,кот.использ.как радиоктивн.индикаторы. С входит в составв органич.в-в,содерж-ся в клетках растений и животных. Из минеральн.соединений наиболее растпространены карбонаты: известняк(или мрамор) СаСО3, магнезит MgCO3. В воздухе содерж-ся углекислый газ – оксид углерода (IV) СО2.При обычных tС хим. инертен, при достаточно высоких соед-ся со многими эл-тами, проявл.сильн.восстановит.св-ва. Хим. активность разных формСубывает в ряду: аморфный углерод, графит, алмаз. Степени окисления +4 (напр., CO2), −4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2).Углекисл. газ реагирует с водой, образуя слабую угольн. к-ту — H2CO3, кот.образует соли — карбонаты. На Земле наиб. распространены карбонаты кальция (мин. формы — мел, мрамор, кальцит, известняк и др.) и магния (мин. форма доломит).Графит с галогенами, щелочными металлами и др. в-вами образует соединения включения. При пропускании электрич. разряда между угольными электродами в атмосфере азота образуется циан. При высоких t взаимодействием углерода со смесью Н2 и N2 получают синильную к-ту:
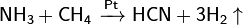
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством металлов углерод образует карбиды, например:
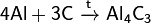
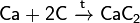
Важна в промышленности реакция углерода с водяным паром:
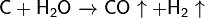
При нагревании C восстанавливает оксиды металлов до металлов. Данное св-во широко исп-ся в металлургической промышленности
Соли угольн. к-ты — твердые кристаллич. в-ва.Карбонат натрия Na2CO3 — сода — важнейший продукт хим.пром-ти.
Применяется:
-Для снижения жесткости воды, т.к. соли кальция и магния, присутствие кот.обуславливает жесткость воды, взаимодействуют с карбонатом натрия с образованием осадка:
CaCl2 + Na2CO3 = 2NaCl + CaCO3↓
-В кач-ве моющего ср-ва, т.к. р-р соды обладает щелочной реакцией вследствие гидролиза:
CO32− + HOH = HCO3−+ OH-
-В производстве стекла, мыла. В нефтяной, целлюлозно-бумажной промышленности.
-Соду в пром-ти получают прокаливанием гидрокарбоната натрия — питьевой соды:
2NaHCO3 = Na2CO3 + H2O + CO2↑
Питьевая сода применяется:
-для выпечки в кач-ве разрыхлителя, лучше с добавлением лимонной к-ты:
NaHCO3 + H+ = Na+ + H2O + CO2↑
-2%-ный р-р — для нейтрализации к-ты, попавшей на кожу (та же реакция)
Питьевая сода тоже гидролизуется и обладает щелочной реакцией р-ра, поэтому применяется для мытья посуды, чистки сантехники и т.п.
Карбонат калия K2CO3 — пота́ш. Белый порошок, расплывающийся во влажном воздухе и хорошо растворимый в воде.Применяется для получения жидкого мыла, тугоплавкого и хрустальн. стекла.Карбонат кальция встречается в природе в виде мела, известняка, мрамора (минерал кальцит). Нерастворим в воде, гидрокарбонат кальция малорастворим.
Применение:
-В строит-ве. Известняк — для кладки стен и, в виде щебня, для бетонных работ, строит-ва дорог. Мел — в виде порошка как наполнитель в шпаклевках, замазках, масти́ках. Мрамор — для облицовки зданий и станций метрополитена.
-Óбжигом известняка в промышленности получают жжёную известь и углекислый газ:
CaCO3 = CaO + CO2↑
-Для известкования кислых почв. Известняк нейтрализует почвен. к-ты, при этом выделяется углекислый газ, повышая рыхлость почвы:
CaCO3 + 2H+= Ca2+ + H2O +CO2↑
Для распознавания карбонатов приливают раствор соляной кислоты, происходит бурное выделение газа:
CaCO3 + 2HCl = CaCl2 + H2O +CO2↑
С также образует соединения с серой,азотом,металлами. Сероуглерод CS2 получают,пропуская пары серы через слой раскаленного угля: С+S2=CS2. Получается бесцветная жидкость с приятным запахом.Ядовит,летуч,применяется для фумигации, используется как р-ритель смол,жиров,иода;огнеопасен. При tэлектрич.дуги углерод с азотом образует дициан C2N2 – бесцветн,ядовитый газ. Подобно галогенам,дицан соединяется с Н,образуя бескислородную цианистоводородную к-ту H2+C2N2=2HCN
Углерод реагирует со многими эл-тами. Соединения с неметаллами имеют свои собств. названия — метан CH4, тетрафторметанCF4.
