Основные типы химических равновесий и процессов в функционировании живых систем
ЗАНЯТИЕ 4
ОСНОВНЫЕ ТИПЫ ХИМИЧЕСКИХ РАВНОВЕСИЙ И ПРОЦЕССОВ В ФУНКЦИОНИРОВАНИИ ЖИВЫХ СИСТЕМ
1. Протолитическая теория кислот и оснований. Протолитические
реакции. Понятия о кислотах и основаниях.
В протолитической теории кислот и оснований выделяется особая группа веществ - протолитов, взаимодействие между которыми осуществляется при передаче протона Н+ (от одного к другому).
Вещества, которые отдают протон, являются кислотами, а вещества, которые протон присоединяют - основаниями.
Ион водорода - протон - обладает уникальностью, то есть отличается от всех других ионов:
1. обладает малыми размерами (в 10000 раз меньше других);
2. обладает высокой подвижностью;
3. единственный ион, у которого отсутствуют электронные оболочки; он может внедряться в электронные оболочки других атомов, образуя водородную связь.
При растворении НСl в Н2О наблюдается протолитическое взаимодействие: НС1 ↔ Н+ + Сl¯ или
НС1 + Н2О↔ Н3О+ + Сl¯
Н3О+ - это ион гидроксония
Согласно этой теории, все кислоты делятся на несколько групп:
1) нейтральные: H2SO4, HC1, Н2О;
2) анионные: HSО4¯, H2PО4¯, НРО42-
3) катионные: NH4+, H3О+.
Основания:
1) нейтральные: Н2О, NH3;
2) анионные: CN¯, СН3СОО¯.
Некоторые вещества обладают амфотерностью, например, вода:
Н2О + Н2SO4 ↔ H3O+ + HSO4 ¯
основание кислота кислота основание
Н2O + :NH3 ↔ NH4+ + ОН ¯
кислота основание кислота основание
Для характеристики протолитических свойств растворителей используется понятие «сродства к протону» - это энергия, которая выделяется при присоединении протона к одной молекуле растворителя. В порядке уменьшения сродства к протону все растворители образуют ряд, например:
NH3 ; H20; C2H5OH; HCN; CH3COOH; HN03; H2S04
уменьшение сродства к H+, усиление кислотных свойств
Таким образом, любой член этого ряда является кислотой ко всем предыдущим членам этого ряда, например:
С2Н5ОН + HCN ↔ С2Н5ОН2+ + CN¯
основание кислота
Наибольшим сродством к протону обладает аммиак (NH3) - он всегда будет основанием. Например, при растворении спирта в аммиаке:
С2Н5ОН + NH3 → NH4+ +С2Н5О ¯
кислота основание
Центральным понятием протолитической теории является протолитическая реакция. Это реакция переноса протона от кислоты к основанию. Первоначально было предложено так называть перенос протона от молекулы кислоты к молекуле растворителя. Прочие реакции переноса протона называли прототропными.В последнее время протолитическими называют любые реакции переноса протона.
После потери протона оставшаяся часть молекулы кислоты становится основанием. Вместе они составляют сопряженную кислотно-основную пару. Такие пары частиц записывают в виде дроби: HCl/Cl–, H2SO4/HSO4–, NH4+/NH3.
Классификация органических кислот и оснований
Кислоты и основания Бренстеда классифицируют по природе атома при кислотном или основном центре.
В зависимости от природы элемента, с которым связан протон, различают четыре основных типа органических кислот Бренстеда:
· O-H – кислоты - карбоновые кислоты, спирты, фенолы;
· S-H – кислоты - тиолы;
· N-H – кислоты - амины, амиды, имиды;
· C-H – кислоты - углеводороды и их производные.
В зависимости от природы атома, к неподеленной паре электронов которого присоединяется протон, основания Бренстеда делят на три основных типа:
o аммониевые основания - амины, нитрилы, азотсодержащие гетероциклические соединения;
o оксониевые основания - спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты и их функциональные производные;
o сульфониевые основания - тиолы, сульфиды.
Особый тип оснований Бренстеда представляют π-основания, в которых центром основности являются электроны π-связи (алкены, арены).
Влияние структурных факторов на относительную силу кислот и оснований
Сила кислоты или основания определяется положением равновесия кислотно-основного взаимодействия и зависит от разности свободных энергий исходных и конечных соединений. Поэтому факторы, которые стабилизируют сопряженное основание в большей степени, чем кислоту, увеличивают кислотность и уменьшают основность. Факторы, стабилизирующие преимущественно кислоту по сравнению с основанием, действуют в противоположном направлении. Поскольку сопряженные основания, как правило, несут отрицательный заряд, то увеличению кислотности способствуют факторы, стабилизирующие анион.
Кислоты и основания Льюиса
Дж. Льюисом была предложена более общая теория кислот и оснований.
Основания Льюиса – это доноры пары электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.)
Кислоты Льюиса – это акцепторы пары электронов, т.е. соединения, имеющие вакантную орбиталь (ион водорода и катионы металлов: H+, Ag+, Na+, Fe2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3).
Таким образом, основания Бренстеда и Льюиса – это одни и те же частицы. Однако основность по Бренстеду есть способность присоединять только протон, в то время как основность по Льюису – понятие более широкое и означает способность к взаимодействию с любой частицей, имеющей низколежащую свободную орбиталь.
Кислотно-основное взаимодействие по Льюису есть доноро-акцепторное взаимодействие и любую гетеролитическую реакцию можно представить как взаимодействие кислоты и основания Льюиса:
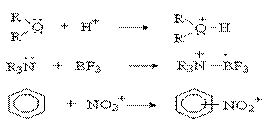
Единой шкалы для сравнения силы кислот и оснований Льюиса не существует, так как их относительная сила будет зависеть от того, какое вещество взято за стандарт (для кислот и оснований Бренстеда таким стандартом является вода). Для оценки легкости протекания кислотно-основного взаимодействия по Льюису Р. Пирсоном была предложена качественная теория «жестких» и «мягких» кислот и оснований.
Жесткие основания обладают высокой электроотрицательностью и низкой поляризуемостью. Они трудно окисляются. Их высшие занятые молекулярные орбитали (ВЗМО) имеют низкую энергию.
Мягкие основания имеют низкую электроотрицательность и высокую поляризуемость. Они легко окисляются. Их высшие занятые молекулярные орбитали (ВЗМО) имеют высокую энергию.
Жесткие кислоты имеют высокую электроотрицательность и низкую поляризуемость. Они трудно восстанавливаются. Их низшие свободные молекулярные орбитали (НСМО) имеют низкую энергию.
Мягкие кислоты обладают низкой электроотрицательностью и высокой поляризуемостью. Они легко восстанавливаются. Их низшие свободные молекулярные орбитали (НСМО) имеют высокую энергию.
Самая жесткая кислота - Н+, самая мягкая – СН3Hg+. Наиболее жесткие основания – F- и OH-, наиболее мягкие – I- и Н-.
Таблица 1. Жесткие и мягкие кислоты и основания.
| Жесткие | Промежуточные | Мягкие |
| Кислоты | ||
| H+, Na+, K+, Mg2+, Ca2+, Al3+, Fe3+, BF3, AlCl3, RC+=O | Cu2+, Fe2+, Zn2+, R3C+ | Ag+, Hg2+, I2 |
| Основания | ||
| H2O, OH-, F-, ROH, RO-, R2O, NH3, RNH2 | ArNH2, Br-, C5H5N | R2S, RSH, RS-, I-, H-, C2H4, C6H6 |
Принцип жестких и мягких кислот и оснований Пирсона (принцип ЖМКО):
Жесткие кислоты преимущественно взаимодействуют с жесткими основаниями, а мягкие кислоты – с мягкими основаниями.
Это выражается в больших скоростях реакций и в образовании более устойчивых соединений, так как взаимодействие между близкими по энергии орбиталями эффективнее, чем взаимодействие между орбиталями, значительно различающимися по энергии.
Принцип ЖМКО используют для определения преимущественного направления конкурирующих процессов (реакции элиминирования и нуклеофильного замещения, реакции с участием амбидентных нуклеофилов); для направленного создания детоксикантов и лекарственных препаратов.
Константа диссоциации.
Константа диссоциации — вид константы равновесия, которая показывает склонность к диссоциации.
Диссоциация протекает с участием полярных молекул Н2О. Чем их больше, тем в большей степени протекает диссоциация.
Основные параметры КОС
| рН | N ≈ 7,4 | (среднее значение в артериальной крови) |
| рСО2 | 40 мм. рт. ст. (парциальное давление СО2 в плазме крови) | Этот компонент непосредственно отражает дыхательный компонент в регуляции КОС (КЩР). ↑(гиперкапния) наблюдается при гиповентиляции, что характерно для дыхательного ацидоза. ↓(гипокапния) наблюдается при гипервентиляции, что характерно для респираторного алкалоза. Однако, изменения рСО2 могут быть и следствием компенсации со стороны метаболических нарушений КОС. Чтобы отличить эти ситуации друг от друга, требуется рассмотреть рН и [НСО3-] |
| рО2 | 95 мм. рт. ст. (парциальное давление в плазме крови) | |
| СБ или SB | 24 мэкв/л | СБ – стандартный бикарбонат плазмы т.е. [НСО3-] ↓ - при метаболическом ацидозе, или при компенсации дыхательного алкалоза. ↑ - при метаболическом алкалозе или при компенсации дыхательного ацидоза. |
Дополнительные индексы
| БО или ВВ (base buffers) | Буферные основания. Это сумма всех анионов цельной крови, принадлежащих буферным системам. |
| ДО или BD (base deficiency) | Дефицит оснований. Это разница между практической и должной величиной БО при метаболическом ацидозе. Определяется как количество оснований, которое необходимо добавить к крови, чтобы довести ее рН до нормы (при рСО2 = 40 мм. рт. ст. tо = 38оC ) |
| ИО или ВЕ (basе excess) | Избыток оснований. Это разница между фактической и должной величинами БО при метаболическом алкалозе. |
В норме, условно говоря, не существует ни дефицита, ни избытка оснований (ни ДО, ни ИО). Фактически, это выражается в том, что разница должного и фактического БО находится в нормальных условиях в пределах ±2,3 мэкв/л. Выход этого показателя из коридора нормы типичен для метаболических нарушений КОС. Аномально высокие значения характерны для метаболического алкалоза. Аномально низкие – для метаболического ацидоза.
Лабораторно-практическая работа
Опыт 1. Сравнение буферной ёмкости сыворотки крови и фосфатной БС
| Отмерить мл | N колбы | |
| № 1 | № 2 | |
| Сыворотка крови (разведение 1:10) | 2,0 | - |
| Фосфатная БС (разведение 1:10), рН = 7,4 | - | 2,0 |
| Фенолфталеин (индикатор) | 2 капли | 2 капли |
Титровать 0,1 н р-ром NаОН до малинового окрашивания (рН = 9,0).
Результаты занести в таблицу
| мл NаОН |
Буферную ёмкость рассчитать по формуле:
V р-ра NаОН х 10 (разведение) х [NаОН] / 2 (мл) (рНпосле титрования – рНисходное)
| Буферная ёмкость | |
| Сыворотка | |
| Фосфатный буфер |
Заключение……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
ЗАНЯТИЕ 4
ОСНОВНЫЕ ТИПЫ ХИМИЧЕСКИХ РАВНОВЕСИЙ И ПРОЦЕССОВ В ФУНКЦИОНИРОВАНИИ ЖИВЫХ СИСТЕМ
1. Протолитическая теория кислот и оснований. Протолитические
реакции. Понятия о кислотах и основаниях.
В протолитической теории кислот и оснований выделяется особая группа веществ - протолитов, взаимодействие между которыми осуществляется при передаче протона Н+ (от одного к другому).
Вещества, которые отдают протон, являются кислотами, а вещества, которые протон присоединяют - основаниями.
Ион водорода - протон - обладает уникальностью, то есть отличается от всех других ионов:
1. обладает малыми размерами (в 10000 раз меньше других);
2. обладает высокой подвижностью;
3. единственный ион, у которого отсутствуют электронные оболочки; он может внедряться в электронные оболочки других атомов, образуя водородную связь.
При растворении НСl в Н2О наблюдается протолитическое взаимодействие: НС1 ↔ Н+ + Сl¯ или
НС1 + Н2О↔ Н3О+ + Сl¯
Н3О+ - это ион гидроксония
Согласно этой теории, все кислоты делятся на несколько групп:
1) нейтральные: H2SO4, HC1, Н2О;
2) анионные: HSО4¯, H2PО4¯, НРО42-
3) катионные: NH4+, H3О+.
Основания:
1) нейтральные: Н2О, NH3;
2) анионные: CN¯, СН3СОО¯.
Некоторые вещества обладают амфотерностью, например, вода:
Н2О + Н2SO4 ↔ H3O+ + HSO4 ¯
основание кислота кислота основание
Н2O + :NH3 ↔ NH4+ + ОН ¯
кислота основание кислота основание
Для характеристики протолитических свойств растворителей используется понятие «сродства к протону» - это энергия, которая выделяется при присоединении протона к одной молекуле растворителя. В порядке уменьшения сродства к протону все растворители образуют ряд, например:
NH3 ; H20; C2H5OH; HCN; CH3COOH; HN03; H2S04
уменьшение сродства к H+, усиление кислотных свойств
Таким образом, любой член этого ряда является кислотой ко всем предыдущим членам этого ряда, например:
С2Н5ОН + HCN ↔ С2Н5ОН2+ + CN¯
основание кислота
Наибольшим сродством к протону обладает аммиак (NH3) - он всегда будет основанием. Например, при растворении спирта в аммиаке:
С2Н5ОН + NH3 → NH4+ +С2Н5О ¯
кислота основание
Центральным понятием протолитической теории является протолитическая реакция. Это реакция переноса протона от кислоты к основанию. Первоначально было предложено так называть перенос протона от молекулы кислоты к молекуле растворителя. Прочие реакции переноса протона называли прототропными.В последнее время протолитическими называют любые реакции переноса протона.
После потери протона оставшаяся часть молекулы кислоты становится основанием. Вместе они составляют сопряженную кислотно-основную пару. Такие пары частиц записывают в виде дроби: HCl/Cl–, H2SO4/HSO4–, NH4+/NH3.
