Теория растворов и сильных электролитов. Ионная сила растворов, коэффициент активности и активность ионов.
В водных растворах сильные электролиты практически полностью диссоциированы, в растворе содержится большое количество ионов, расстояние между которыми мало. В результате около каждого иона находятся преимущественно ионы противоположного знака, и образуется так называемая “ионная атмосфера”.
Как следствие, возникает эффект уменьшения числа ионов, участвующих в химических процессах. Ионы ориентируются друг относительно друга и поэтому их эффективная концентрация (активность) отличается от истинной.
Под активностью электролита x понимают эффективную концентрацию в соответствии с которой он участвует в различных процессах.
Активность связана с истинной концентрацией растворенного вещества
a(x) = f(x)∙C(x)
a(x) – активность электролита, моль/л
C(x) – концентрация, моль/л
f(x) – коэффициент активности (величина безразмерная)
Коэффициент активности 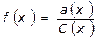 выражает отклонение раствора с концентрацией C(x) от поведения раствора при бесконечном разведении, т.е. в отсутствии межионных взаимодействий.
выражает отклонение раствора с концентрацией C(x) от поведения раствора при бесконечном разведении, т.е. в отсутствии межионных взаимодействий.
Если f(x) = 1 – это означает, что движения ионов не ограничены действием электростатических сил и a=C.
Если f(x) < 1, то на движение ионов оказывает влияние их электростатическое взаимодействие и вместо концентрации C надо подставлять активность a.
Если f(x) = 1 → a(x) = C(x)
Если f(x) < 1 → a(x) < C(x)
Активность (эффективная концентрация) ионов какого-то одного вида из-за их взаимодействия зависит от общего содержания ионов в растворе. Мерой этого общего содержания ионов является ионная сила раствора I
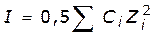
I– это полусумма произведений концентраций ионов на квадрат их зарядов. Для устранения влияния знака заряда необходимо возведение Z (заряда) в квадрат. Из определения следует, что ионная сила должна измеряться в тех же единицах, что и концентрация (на практике часто ее пишут без размерности).
Ионная сила бинарного электролита, диссоциирующего на 2 однозарядных иона численно равна его концентрации.
[I] = [C] = [моль/л]
Например: AB (KCl → K+ + Cl-)
I = 0,5(0,1∙12 + 0,1∙12) = 0,1
Во сколько раз ионная сила больше концентрации для электролита типа A2B3, например для
Al2(SO4)3
Пусть концентрация данного электролита условно равна C
[Al+3] = 2C
[SO42-] = 3С
I = 0,5(2C∙32 + 3C∙22) = 15C, J = 15 С, т.е. в 15 раз
Еще рассмотрим пример: фосфатный буфер
Пусть C1 = C(NaH2PO4) = 0,1M
C2 = C(Na2 HPO4) = 0,05M
Находим концентрации ионов:
[Na+] = C1 + 2C2 = 0,1 + 2∙0,05 = 0,2M
[H2PO4-] = 0,1
[HPO42-] = 0,05
I = 0,5(0,2∙12 + 0,1∙12 + 0,05∙22) = 0,25
В 1923 Дебай и Хюккельпоказали, что для разбавленных водных растворов с ионной силой I ≤ 0,01 коэффициенты активности ионов можно рассчитать по формуле
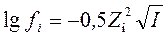
fi– коэффициент активности i-го катиона (аниона)
Zi– заряд i-го катиона (аниона)
Данное уравнение является математическим выражением предельного закона Дебая–Хюккеля (1921): в разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны независимо от их химической природы.
Приведенная формула справедлива лишь для растворов с низкой ионной силой I ≤ 0,01, потому-то и выражает предельный закон.
