Растворы: коллигативные свойства, способы выражения концентраций. гетерогенные равновесия
ЗАНЯТИЕ 3
РАСТВОРЫ: КОЛЛИГАТИВНЫЕ СВОЙСТВА, СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
Особенности физико-химических свойств воды
Организм взрослого человека на 65% состоит из воды, а новорождённого – на 75%. ⅔ от общего количества воды составляет внутриклеточная вода, ⅓ - внеклеточная.
Вода поступает в организм двумя путями:
1) алиментарным (еда, питьё) – 1,5-2,0 литра в сутки; 2) эндогенным (вода, образующаяся при метаболических превращениях) – 0,35-0,4 л/ в сутки.
Вода в организме участвует в:
1) процессах метаболизма;
2) терморегуляции как теплоноситель и хладагент;
3) трансформации энергии (синтез и гидролиз макроэргических соединений);
4) процессе диссоциации электролитов как полярный растворитель;
5) растворении минеральных и органических веществ, газов, жидкостей.
Свойства воды объясняются строением её молекул и структурированностью.
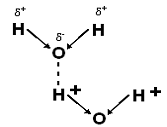
Молекула воды имеет 2 ковалентные полярные связи – О-Н. Электронная плотность в них сдвинута в сторону более электроотрицательного кислорода, имеющего 2 неподелённые электронные пары. Вследствие этого, на обоих атомах водорода локализуются частичный положительный заряд – δ+, а на атомах кислорода – частичный отрицательный – δ-. Т.о., молекулы Н2О – биполярные, что определяет взаимодействие между ними. Благодаря такому распределению зарядов, соседние молекулы Н2О могут притягиваться друг к другу за счёт сил электростатического взаимодействия между атомом кислорода одной молекулы Н2О и атомом водорода другой (рис. 1).
|
Такой тип электростатического притяжения называют водородной связью. Молекулы воды находятся в непрерывном движении, поэтому водородные связи постоянно быстро разрушаются и вновь образуются. За счёт водородных связей между молекулами воды образуются тетраэдры или кластеры. Молекулы воды, которые не образуют тетраэдры, могут входить и выходить из кластеров (рис. 2).
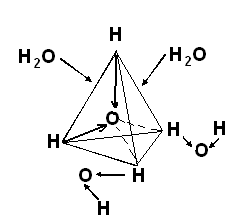
Рис. 2. Кластеры воды
Водородные связи слабее ковалентных. Однако, благодаря их многочисленности, они обеспечивают многие аномальные физические свойства воды:
1) высокую удельную теплоёмкость;
2) высокую температуру кипения;
3) высокую температуру кристаллизации;
4) высокую удельную теплоту испарения;
Вода, как полярный растворитель, имеет хорошую растворяющую и диссоциирующую способность. Водородные связи образуются при растворении в воде кристаллических солей, способных ионизироваться молекулами Н2О, и многих органических соединений (альдегиды, аминокислоты, спирты, кетоны, углеводы). Растворимость этих веществ обусловлена способностью молекул Н2О образовывать водородные связи с функциональными группами этих соединений.
В воде могут находиться в диспергированном (раздробленном состоянии) вещества, содержащие в своём составе одновременно гидрофобные и гидрофильные группы. Такие соединения называют амфипатическими. Примерами могут служить калиевые и натриевые соли высших жирных кислот (ВЖК) – мыла. Ионизированная в воде карбоксильная группа ВЖК или её соли образует полярную головку, а углеводородный радикал – гидрофобный хвост (рис.3).
 |
Рис. 3. Строение амфипатических веществ
Соль ВЖК легко диспергируется в воде, образуя агрегаты называемые мицеллами. В них гидрофобные хвосты жирной кислоты скрыты от водной фазы внутри мицеллы, а полярные головки обращены к Н2О, образуя с ней водородные связи (рис. 4). На этом свойстве основана способность амфипатических веществ поддерживать в диспергированном в воде состоянии даже неполярные вещества. Именно так происходит эмульгирование пищевых жиров в двенадцатиперстной кишке под действием амфипатических веществ, содержащихся в жёлчи – жёлчных кислот и фосфолипидов.
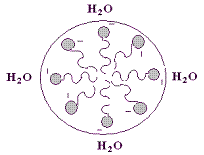 |
Рис. 4. Диспергирование в воде амфипатических веществ
Водородные связи характерны не только для воды, они широко распространены в биологических системах. Водородные связи легко образуются между любым электроотрицательным атомом (F, О или N) и атомом Н, ковалентно связанным с другим электроотрицательным атомом. Приведём несколько примеров возникновения водородных связей в биологических системах:
1. Между комплементарными азотистыми основаниями нуклеиновых кислот, стабилизируя их вторичную структуру. Водородные связи возможны между А и Т, а также между Г и Ц.
2. Водородные связи стабилизируют вторичную, третичную и четвертичную структуры белковых молекул.
Рис. 5. Кривые растворимости некоторых солей в вод
температуры раствормость твердых веществ возрастает, однако растворимость Ca(OH)2, CaCO3, CaSO4 уменьшается. Растворимость NaCl от температуры зависит слабо.
3. Давление. При растворении твердых веществ в жидкостях (или жидкости в жидкости) объем существенно не изменяется, поэтому изменение давления на растворимость в этом случае практически не влияет. Растворение газа в жидкости всегда сопровождается уменьшением объема, поэтому в случае газов повышение давления увеличивает их растворимость в жидкостях, а понижение давления, наоборот, уменьшает.
Растворимость не следует путать со скоростью растворения. Например, растворимость кускового сахара и сахарного песка одинаковые, однако насыщенный раствор сахара в воде быстрее образуется в случае сахара-песка (сахар-песок растворяется быстрее, так как в этом случае больше поверхность соприкосновения растворителя и растворяемого вещества). Повышению скорости растворения твердого вещества в жидкости способствует перемешивание, однако на растворимость оно не влияет.
Отметим, что не для всяких веществ можно получить насыщенные растворы. Есть вещества, растворимость которых в воде неограниченна: метанол, этанол, пропанол-1 и пропанол-2, уксусная, серная, муравьиная, пропановая и азотная кислоты, этаналь, этиленгликоль, глицерин.
Для растворов веществ, неограниченно смешивающихся с водой, понятия «насыщенный» и «ненасыщенный» не применимы (нельзя, например, говорить: насыщенный раствор серной кислоты). Очевидно, понятия «разбавленный» и «концентрированный» для веществ, неограниченно растворяющихся в воде, применимы
Решение.
Молярная масса хлорида железа (III):
M(FeCl3) = 162 г/моль.
Фактор эквивалентности fэк = 1/3.
Молярная масса эквивалента
Mэк(FeCl3) = fэк(FeCl3)•M(FeCl3) = 162 • (1/3) = 54 г/моль.
Количество эквивалента вещества, содержащегося в 40 г хлорида железа (III), составляет:
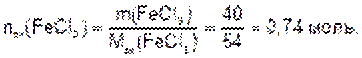
Масса раствора:
mp = m(FeCl3) + m(H2O);
r(H2O) = 1 г/мл; m(H2O) = 200 • 1 = 200 г;
mp = 40 + 200 = 240 г.
Объем раствора: 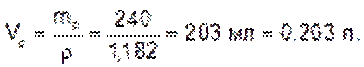
Находим молярную концентрацию эквивалента раствора хлорида железа (III):
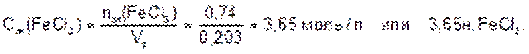
Моляльная доля растворенного вещества (Моляльность) [моль/кг] - безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
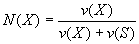
где N(Х) - мольная доля растворенного вещества X; v(Х) - количество растворенного вещества X, моль;
v(S) - количество вещества растворителя S, моль.
Рис.7. Гипотеза Старлинга в норме
Таким образом, в артериальной части, где преобладает Ргидр, это способствует выходу безбелковой части плазмы и с ней веществ из крови в межклеточную жидкость. Оттуда питательные вещества поступают в клетки. В венозной части более высокое Ронк вызывает движение тока жидкости и с ней веществ по осмотическому градиенту из клеток окружающих тканей в кровь. Происходит выведение метаболитов и продуктов распада из клеток. В физиологических условиях отток безбелковой части плазмы равен притоку, т.к. разность давлений в артериальной и венозной части одинаковая.
При нарушении этого равновесия может развиваетсяся отёк. Отёк – накопление внесосудистой жидкости. Одна из причин отёка – гипопротеинемия – уменьшение концентрации белков в плазме, ведущая к снижению онкотического давления. Она возникает вследствие длительного голодания («голодные отёки»), нарушения синтеза белков для плазмы в печени, потери с мочой при заболеваниях почек, обширных ожогах и т. п.
Ионное произведение воды.
Вода – слабый электролит, она диссоциирует в незначительной степени (при температуре 298 K на ионы распадается 1 молекула из 5,5х108). Однако образующиеся при диссоциации воды ионы играют исключительно важную роль в биологических процессах. Поэтому необходимо уметь количественно выражать меру диссоциации воды. Выражение для константы равновесия диссоциации воды:
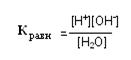
При температуре 298 К эта величина равна 1,8 х 10-16 моль/л. Так как диссоциации воды мала, её концентрацию можно считать постоянной и рассчитать по формуле:
[Н2О] = m /Mr
где: m – масса 1л воды, Mr – её молярная масса. Подставив числовые значения этих величин в уравнение 1.2, получаем: 1000 г/л / 18 г/моль = 55,5 моль/л. Умножив обе части уравнения 1.1 на концентрацию воды, получаем:
Кравн.[Н2О] = [Н+][ОН-]
и, подставляя числовые значения, получаем:
К w = 1,8 х 10-16 моль/л х 55,5 моль/л = 10-14 моль2/л2,
где К w – ионное произведение воды. С ростом температуры увеличивается число диссоциациировавших молекул воды и, следовательно, увеличивается ионное произведение воды.
Если [Н+] = [ОН-], то раствор имеет нейтральную реакцию, если преобладают ионы Н+, то раствор кислый, если ОН- – щелочной.
В 1909 г. Зёренсен предложил использовать для выражения концентрации протонов водородный показатель – рН, равный десятичному логарифму концентрации протонов, взятому с противоположным знаком:
pH = -lg [Н+]
Так как ионное произведение воды для данной температуры – величина постоянная, увеличение концентрации одного из ионов влечёт снижение концентрации другого. Зная рН, легко вычислить рОН: рОН = 14 – рН и наоборот.
pH может принимать значения от 1 до 14. Среду со значением рН от 0 до 3 называют сильно кислой, 3-6 – кислой, 7 – нейтральной, 8-10 – слабо щелочной, 11-14 – сильно щелочной.
Биологическое значение постоянства рН состоит в том, что ферменты, контролирующие скорости протекания химических реакций в организме, будучи белками, очень чувствительны к колебаниям рН. Даже незначительный сдвиг реакции среды от оптимума для данного фермента приводит к существенному снижению его биологической активности, а, следовательно, к серьёзным метаболическим нарушениям. Вот почему значения водородного показателя среды поддерживается в узких рамках.
Надо отметить, что сами значения рН в разных частях организма могут существенно отличаться. Так, рН желудочного сока составляет 1,5-2,3; слюны – 6,8; мочи – 5,0-6,5; дуоденального содержимого – 7,6-7,8; крови – 7,36-7,42.
Поддержание оптимального значения реакции среды в различных частях организма достигается благодаря согласованной работе буферных систем и органов выделения.
9. Методы определения рН растворов. Индикаторы.
pH можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
1. Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы - органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах - либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы. Их преимуществом является дешевизна, быстрота и наглядность исследования.
Таблица 1
ЗАНЯТИЕ 3
РАСТВОРЫ: КОЛЛИГАТИВНЫЕ СВОЙСТВА, СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
